1、选择题 能正确表示下列反应的离子方程式的是
A.以石墨为电极电解MgCl2溶液:2Cl-+2H2O H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH-
B.NH4Cl水溶液显酸性:NH4++H2O=NH3 H2O+H+
H2O+H+
C.AlCl3溶液中投入过量Na:Al3++4Na+2H2O=AlO2-+4Na++2 H2↑
D.FeBr2溶液中通入少量Cl2:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-
参考答案:
C
本题解析:
A项,电解方程式为 +2Cl-
+2Cl-
 +Cl2↑;B项,水解反应应为可逆反应;D项,少量的Cl2只能把Fe2+氧化到Fe3+,而不能把Br-氧化(过量则可以)。
+Cl2↑;B项,水解反应应为可逆反应;D项,少量的Cl2只能把Fe2+氧化到Fe3+,而不能把Br-氧化(过量则可以)。
本题难度:一般
2、选择题 下列离子方程式书写正确的是( )
A.过量的SO2通入NaOH溶液中:SO2+2OH-=SO32-+H2O
B.Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-=2Fe2++I2
C.盐酸滴入氨水中:H++OH-=H2O
D.硫酸亚铁溶液与稀硫酸、双氧水混合:2Fe2++H2O2+2H+=2Fe3++2H2O
参考答案:A、SO2过量,生成产物应为HSO3-而不是SO32-,正确的应为SO2+OH-=HSO3-,故A错误;
B、酸性环境中,NO3-具有强氧化性,其氧化性大于Fe3+,能氧化I-成I2,正确的为2NO3-+6I-+8H+=2NO+3I2+4H2O,故B错误;
C、氨水为弱碱,在离子方程式中不能拆开写,正确写法为H++NH3?H2O=NH4++H2O,故C错误;
D、双氧水具有氧化性,在酸性条件下能把Fe2+氧化为Fe3+,同时生成水,离子反应式两边的电荷守恒和得失电子守恒,故D正确;
故选D.
本题解析:
本题难度:简单
3、选择题 下列离子方程式书写正确的是?(?)
A.少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO- = CaSO3↓+2HClO
B.NH4HSO3溶液与足量的NaOH溶液混合后加热:NH4+ +HSO3- +2OH-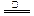 NH3↑+SO32-+2H2O
NH3↑+SO32-+2H2O
C.酸性条件下KIO3溶液与KI溶液发生反应生成I2:IO3- +5I-+3H2O=3I2+6OH-
D.氢氧化钙溶液与等物质的量的稀硫酸混合:Ca2++OH-+H++SO42- = CaSO4↓+H2O
参考答案:B。
本题解析:Ca(ClO)2具有强氧化性,应把SO2氧化成SO42-,产物中不可能有CaSO3生成, A错;B项中,NaOH过量,不是以NH3·H2O的形式存在,而以NH3气体的形式放出,正确。选项C中在酸性条件下,不可能有OH-生成,正确的离子方程式应为IO3- +5I-+6H+ = 3I2+3H2O;D项中,因微溶的Ca(OH)2就是溶液,所以生成的微溶的CaSO4会因溶液体积增大而更难沉淀,其正确的离子方程式应为OH-+H+ = 2H2O,D项错。
本题难度:简单
4、实验题 在硝酸铅[Pb(NO3)2]的稀溶液中滴入几滴稀硫酸,生成白色PbSO4沉淀,再滴入数滴饱和醋酸钠溶液,微热并不断搅动,沉淀慢慢溶解.以上发生的都是复分解反应,写出反应过程的离子方程式??、?,试推测第二步离子反应发生的原因是?
参考答案:Pb2++SO42-=PbSO4↓;PbSO4+2CH3COO-=(CH3COO)2Pb+SO42-;生成了弱电解质。
本题解析:题中已知了反应都是复分解反应,而此类离子反应的发生条件为①有难溶物生成,②有挥发性物质生成,③有弱电解质生成.第一步离子反应已给出了PbSO4沉淀,则离子方程式为Pb2++SO42-=PbSO4↓。第二步按复分解反应的规律可写出化学方程式为:PbSO4+2CH3COONa=(CH3COO)2Pb+Na2SO4,产物中无难溶物、无挥发性物质,则推测(CH3COO)2Pb一定为弱电解质,故离子方程式为:PbSO4+2CH3COO-=(CH3COO)2Pb+SO42-。
本题难度:简单
5、选择题 下列化学方程式或离子方程式中,书写正确的是
A.氢氧化铜溶于醋酸溶液中:Cu(OH)2+2H+==Cu2++2H2O
B.乙醛的银镜反应:CH3CHO+Ag(NH3)2OH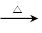 CH3COONH4+NH3+Ag↓+H2O
CH3COONH4+NH3+Ag↓+H2O
C.苯酚钠溶液中通入少量二氧化碳:C6H5O-+CO2+H2O C6H5OH+HCO3-
C6H5OH+HCO3-
D.丙烯聚合: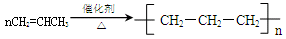
参考答案:C
本题解析:A错,醋酸为弱酸,不能拆成离子形式;B错,醛与银氨溶液反应的关系为1mol醛基2mol银;C正确;D错,丙烯聚合: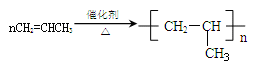 ;
;
本题难度:一般