1、计算题 (7分) 2.4g的镁粉在100mL稀硫酸中完全溶解(反应前后溶液体积的变化忽略不计)。
(1)写出反应的离子方程式,并标出电子转移的方向和数目。
(2)求产生的气体在标准状况下的体积。
(3)求反应完全后所得溶液中镁离子的物质的量浓度。
参考答案:(1)
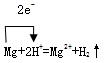
(2) 2.24L (3) 1mol/L
本题解析:
(1) 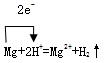 ;
;
(2)假设生成氢气的体积为V, 则Mg+2H+ = Mg2++H2↑;
24g 22.4L
2.4g V
解得V=2.24L;(3)2.4g镁的物质的量为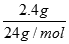 =0.1mol,生成镁离子的物质的量为0.1mol,浓度为
=0.1mol,生成镁离子的物质的量为0.1mol,浓度为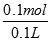 =1mol/L,故答案为1mol/L
=1mol/L,故答案为1mol/L
考点:物质的量的有关计算
本题难度:一般
2、选择题 由15gA物质和10.5gB物质完全反应后,生成7.2gC物质、1.8gD物质和0.3molE物质,则E物质的摩尔质量是(? )
A.100g/mol
B.111g/mol
C.55g/mol
D.27.5g/mol
参考答案:C
本题解析:根据质量守恒定律可知,生成物E的质量是15g+10.5g-7.2g-1.8g=16.5g,所以根据m=nM可知,E的摩尔质量是16.5g÷0.3mol=55g/mol,答案选C。
点评:该题是基础性试题的考查,也是高考中的常见考点。试题基础性强,侧重对学生基础知识的巩固和训练,有利于培养学生的逻辑推理能力。该题的关键是利用好质量守恒定律,然后根据关系式直接列式计算即可。
本题难度:一般
3、选择题 用NA表示阿伏加德罗常数的值。下列叙述不正确的是?
A.2.3 g Na和足量的O2完全反应,在常温和燃烧时,转移电子数均为0 .1NA
B.含0.2 mol H2SO4的浓硫酸与足量铜反应,生成SO2的分子数为0.1 NA
C.100 mL 1 mol·L-1 AlCl3溶液中含阳离子数小于0.1NA
D.含有NA个NO2、N2O4分子的混合气体,降低温度,混合气体的分子总数小于NA
参考答案:B
本题解析:略
本题难度:一般
4、计算题 常温下,在27.5g水中溶解12.5g CuSO4·5H2O,恰好达到饱和,该溶液密度为1.21g /cm3,求:
(1)该溶液中阴阳离子的总物质的量
(2)该溶液中CuSO4的物质的量浓度?
(3) 取出20.0 ml该溶液,配成浓度为1.00 mol/L的稀溶液,则稀释后溶液的体积是多少毫升?
参考答案:(1)0.100mol
(2)1.51mol/L
(3)30.2 mL
本题解析:
本题难度:一般
5、选择题 0.5L 1mol/L FeCl3溶液与0.2L1mol/L KCl溶液中的Cl-的数目之比(? )
A.5:2
B.3:1
C.15:2
D.1:3
参考答案:C
本题解析:根据化学式可知,0.5L 1mol/L FeCl3溶液与0.2L1mol/L KCl溶液中的Cl-的物质的量分别是1.5mol和0.2mol,所以数目之比是15︰2,答案选C。
本题难度:一般