1、选择题 关于用水制取二级能源氢气,以下研究方向正确的是(?)
A.构成水的氢和氧都是可以燃烧的物质,因此,可研究在水不分解的情况下,使氢成为二级能源
B.设法将太阳光聚集,产生高温,使水分解产生氢气
C.寻找高效催化剂,使水分解产生氢气,同时释放能量
D.寻找特殊化学物质,用于开发廉价能源,以分解水制取氢气
参考答案:BD
本题解析:略
本题难度:简单
2、选择题 把0.05molNaOH分别加入到下列100mL溶液中,溶液的导电能力变化不大的是
A.自来水
B.0.5mol/L盐酸
C.0.5mol/L醋酸
D.0.5mol/L氯化铵
参考答案:BD
本题解析:导电能力变化不大,说明该溶液中在加入NaOH前后离子浓度无显著变化。A选项中自来水中加入NaOH后离子浓度发生显著变化。C选项中醋酸为弱电解质,反应前离子浓度较小,加入NaOH后发生CH3COOH+NaOH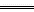 CH3COONa+H2O生成强电解质CH3COONa,离子浓度显著增大。故A、C不选。B、D选项中原溶液中本来就是强电解质,加入NaOH后虽然发生了化学反应,但溶液仍然是强电解质的溶液,且物质的量相等,离子浓度变化不大,故符合题意。
CH3COONa+H2O生成强电解质CH3COONa,离子浓度显著增大。故A、C不选。B、D选项中原溶液中本来就是强电解质,加入NaOH后虽然发生了化学反应,但溶液仍然是强电解质的溶液,且物质的量相等,离子浓度变化不大,故符合题意。
本题难度:一般
3、选择题 常温下,将pH=13的NaOH溶液与pH=2的HCl溶液按1∶9的体积比混合,设混合溶液的总体积为二者相加,则所得混合液的pH值是
A.11
B.15
C.12
D.7.5
参考答案:A
本题解析:
正确答案:A
C(OH―)=(0.1mol/L×1L-0.01mol/L×9L)÷10L=0.001mol/L,c(H+)=10-14 mol/L /0.001 mol/L =10-11mol/L;pH=-lg10-11=11
本题难度:一般
4、选择题 某实验小组学生用50 mL 0.50 mol/L的盐酸与50 mL 0.55 mol/L 的NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量计算反应热.下列说法正确的是(?)
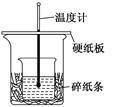
A.如图条件下实验过程中没有热量损失
B.若改用60 mL 0.50 mol/L盐酸跟50 mL 0.55 mol/L的NaOH溶液进行反应,从理论上说所求反应热相等
C.图中实验装置缺少环形玻璃搅拌棒
D.烧杯间填满碎纸条的作用是固定小烧杯
参考答案:C
本题解析:根据装置图可知,小烧杯和大烧杯的杯口没有相平大、小烧杯之间也没有填满泡沫塑料,所以不可能没有热量损失。反应热与参加反应的物质的物质的量有关系,所以改变盐酸的量,反应热是不同的,因此正确的答案是C。
本题难度:一般
5、填空题 (4分)现代生活离不开铝,工业上以铝土矿为原料生产铝。现将一定量某铝土矿样品(主要成分Al2O3)溶于过量稀盐酸并制成500?mL溶液。取100?mL该溶液,测得其中含 有H+、Cl―、Mg2+、Al3+、Fe3+ 五种离子(不考虑其它离子)。已知部分离子的物质的量浓度为:
c(H+)?= 0.02?mol·L―1? c(Mg2+)= 0.01?mol·L―1
c(Fe3+)= 0.02?mol·L―1?c(Cl―)?= 0.52?mol·L―1?
(1)溶液中Al3+ 物质的量浓度为?mol·L―1
(2)则该铝土矿样品中Al2O3的质量为?g。(精确至0.01 g)
参考答案:(1)0.14mol·L―1?(2)3.57g
本题解析:溶液中,离子的正负电荷守恒,正电荷总数等于负电荷总数,即0.52?mol·L―1?×0.1L = (0.02?mol·L―1? + 0.01?mol·L―1×2 + 0.02?mol·L―1 ×3 + 3X)×0.1L ,解得Al3+ 物质的量浓度X=0.14mol·L―1?。铝土矿样品溶于稀盐酸,主要反应为Al2O3 + 6HCl ="=" 2AlCl3 + 3H2O,故Al2O3的质量为m =" 102" g/mol×(0.14mol·L―1×0.5L )/2 = 3.57g
点评:本题考查学生对两个守恒的理解,即溶液的电荷守恒和物质的量守恒,找到了这两个守恒,化学方程式的计算就显得很简单。
本题难度:一般