1、选择题 用下图所示装置制取表中的四种干燥、纯净的气体(图中加热及气体收集装置均已略去;必要时可以加热;a、b、c、d表示相应仪器中加入的试剂)。
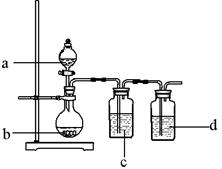
?
| 气体
| a
| b
| c
| d
|
A
| CO2
| 稀盐酸
| CaCO3
| 饱和Na2CO3
| 浓H2SO4
|
B
| Cl2
| 浓盐酸
| MnO2
| NaOH溶液
| 浓H2SO4
|
C
| SO2
| 稀H2SO4
| Cu
| 品红溶液
| 浓H2SO4
|
D
| O2
| H2O2
| MnO2
| 浓H2SO4
| 浓H2SO4
|
上述方法中可以得到干燥、纯净的气体是
A.CO2
B.Cl2
C.SO2
D.O2
参考答案:D
本题解析:略
本题难度:简单
2、选择题 用0.20mol/L的NaOH溶液滴定100.0mL0.20mol/LHCl溶液时,滴定误差在±0.1%以内,反应完毕后溶液的pH变化范围是
A.5~9
B.4.0~10.0
C.4.3~9.7
D.以上都不正确
参考答案:B
本题解析:(1)计量点前计量点前误差为+0.1%时,即滴入NaOH的体积为99.9mL,NaOH不足。
此时锥形瓶溶液中是中和生成的NaCl和剩余的HCl。所以只要计算该溶液的PH值即可。
剩余的n(HCl)=n(HCl总)-n(NaOH)=0.2*(100.00-99.9)*10^-3=2*10^-6(mol)
则PH(前)=lg[c(HCl)]=4。
(2)计量点后半滴,即加入NaOH的体积为100.1mL,NaOH过量,此时为NaCl和NaOH的混合溶液,所以计算时只需考虑NaOH即可。
n(NaOH过量)=n(NaOH总)-n(NaOH反应)=0.2*(100.1-100)*10^-3)=2*10^-5(mol)
此时溶液体积v=100.00+100.1=200.1mL=200.1*10^-3(L),
所以[OH-]=n(NaOH过量)/v="2*10^-5/(200.1*10^-3)=1/100.05" *10^-2(mol/L)
[H+]=10^-14/[OH-]? PH(后)=-lg[H+]=10所以突跃范围为4~10。故选B。
点评:酸碱中和滴定突跃范围的计算实际上也是强酸、强碱互相混合的计算,其规律是
(3)酸I+碱II
完全中和:[H+] =" [OH-]" = 1 mol/L
mol/L
酸过量:? [H+]= 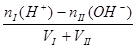
碱过量:[OH-] = 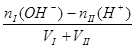
滴定突跃范围指计量点前半滴和后半滴滴定剂所引起的锥形瓶中溶液PH值的变化范围。要控制误差为+/-0.1%时。由于计量点时酸碱恰好完全反应,也就是滴入NaOH的体积为100.00mL时达计量点,所以计量点前误差为+0.1%时,是指加入NaOH的体积为99.9mL,而计量点后误差为-0.1%时指加入NaOH的体积为100.1mL。因此计算滴定突跃范围,只要计算出计量点前、后半滴时锥形瓶中溶液的PH(前)和PH(后)即可。
本题难度:简单
3、实验题 (14分)某校化学课外活动小组利用下面所提供的仪器装置和药品制取NaHCO3溶液,设计如下实验。实验室提供的药品、仪器装置如下:
药品:①2%NaOH溶液 ②稀HCl ③稀H2SO4 ④饱和KHCO3溶液 ⑤浓H2SO4 ⑥CaCO?3固体 ⑦K2CO3粉末
仪器装置(如图所示):
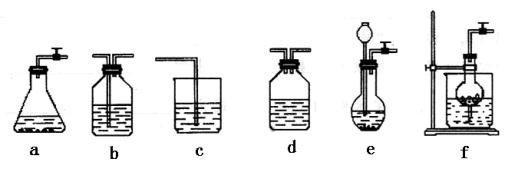
请根据题目要求回答下列问题:
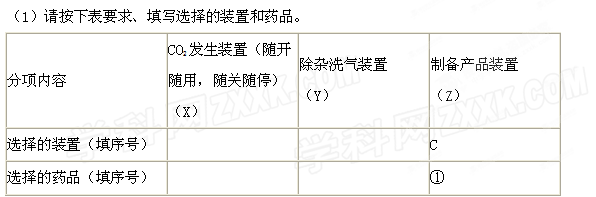
(2)如何检验所选择的CO?2发生装置(X)的气密性,请写出主要操作过程: 。
(3)将装置按X、Y、Z顺序连接并检查气密性后,当加入药品实验时,X装置中发生化学反应的离子方程式为 ,Y装置中除去的杂质为 。
(4)常温下,向Z装置的NaOH溶液中通入过量CO?2气体,其原因是 ;通入 过量CO2后,Z装置内的溶液中离子浓度大小顺序为 ;若要保证乙装置中不析出晶体(不考虑过饱和溶液问题),NaOH溶液最大浓度不能超过 %(质量分数)。
过量CO2后,Z装置内的溶液中离子浓度大小顺序为 ;若要保证乙装置中不析出晶体(不考虑过饱和溶液问题),NaOH溶液最大浓度不能超过 %(质量分数)。
附:有关物质在常温(20℃)时的溶解度
化学式
| Na2CO?3
| NaHCO3
| NaOH
| NaCl
| Na2SO4
|
溶解度(g/100gH?2O)
| 21.3
| 9.60
| 107
| 35.8
| 19.4
参考答案:(14分)答案(1)(各1分)
选择的装置(填序号)
f
b
选择的药品(填序号)
②⑥
④
(2)(2分)方案1:塞紧单孔塞,关闭开关,)将烧杯中加入一定量水使干燥管下端管口浸没在水中,如果干燥管内外液面有一定高度差,说明装置的气密性良好。方案2:塞紧单孔塞,关闭开关,将烧杯中加入一定量水使干燥管下端管口浸没在水中,如果用手捂住干燥管,管口处出现少量气泡,松手后,干燥管下端管口处出现一段水柱,说明装置的气密性良好(其他方案合理均给分)
(3)CaCO3+2H+=Ca2++CO2↑+H2O,(1分)HCl(或氯化氢)(1分)
(4)使溶液中的NaOH完全转化为NaHCO3(1分)
c(Na+)>c(HCO3-)>c(OH-)>c(H+)]([或c(Na+)>c(HCO3-)>c(OH-)>c(CO32-)>c(H+)] (2分)
4.40%(4.39%或4.41%)(3分)
本题解析:略
本题难度:一般
4、选择题 下图是制取、干燥和收集某气体的实验装置,可用于(?)
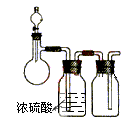
A.用Zn与稀H2SO4反应制H2
B.用CaO与浓氨水反应制NH3
C.用Cu与稀HNO3反应制NO
D.用MnO2与浓HCl反应制C12
参考答案:A
本题解析:根据装置图可知,干燥剂是浓硫酸,所以不能干燥氨气,B不正确。收集装置是短进长出,说明被收集的气体密度小于空气的,NO和氯气的密度均大于空气的,所以正确的答案是A。
本题难度:简单
5、填空题 (10分)CO是一种无色、无味且不溶于水的有毒气体,其制法有:
(1)实验室可用甲酸和浓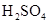 共热制取CO. 共热制取CO.

a.甲酸和浓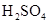 应怎样混合?浓 应怎样混合?浓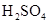 起什么作用? 起什么作用?
b.请据实验原理选择所需主要玻璃仪器(导管除外).
c.怎样收集CO气体?
(2)实验室还可用草酸晶体与浓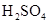 共热制取CO. 共热制取CO.
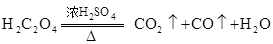
请问:怎样才能得到不含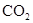 的CO气体? 的CO气体?
(3)工业上用焦炭和水在高温下发生反应制取CO,其化学方程式为:____________
____.在此条件下,C和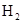 的还原性谁强? 的还原性谁强?
参考答案:(1)a.将甲酸滴入热的浓H2SO4中.脱水作用. b.分液漏斗(装甲酸)、圆底烧瓶(装浓H2SO4)、酒精灯、干燥管、集气瓶. c.用排水法收集.
(2)通过碱石灰或NaOH溶液. (3)C+H2O(g)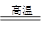 H2+CO?还原性C>H2 H2+CO?还原性C>H2
本题解析:(1)a 浓硫酸具有脱水性,且甲酸的密度小于浓硫酸的,所以要得到CO,应该将甲酸滴入热的浓H2SO4中。
b 该实验原理是液体和液体之间加热制取气体的,所以需要的仪器有分液漏斗(装甲酸)、圆底烧瓶(装浓H2SO4)、酒精灯、干燥管、集气瓶。
c? CO不溶于水,且密度和空气很接近,所以应该用用排水法收集。
(2)CO2是酸性氧化物,能溶于碱中,所以要除去CO中的CO2,可以将混合气通过碱石灰或NaOH溶液。
(3)高温下,碳和水蒸气反应的生成物是氢气和CO,所以方程式为C+H2O(g)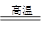 H2+CO。根据氧化还原反应中,还原剂的还原性大于还原产物的可判断,还原性是C>H2. H2+CO。根据氧化还原反应中,还原剂的还原性大于还原产物的可判断,还原性是C>H2.
本题难度:一般
|