1、填空题 (8分)已知由短周期元素组成的A、B、C、D四种常见化合物分子中所含原子数目依次为2、3、4、5,其中A、B含有18个电子,C、D含有10个电子。请回答:
(1)D中含有的化学键类型有?,已知8gD与O2完全燃烧,生成稳定化合物时放出445kJ的热量,写出反应的热化学方程式?。
(2)室温下,若向一定量C的稀溶液中逐滴加入物质的量浓度相同的A,直至A过量,生成化合物XY4Z(X 、Y、Z表示元素符号)。讨论上述实验过程中离子浓度的大小顺序、对应溶质的化学式和溶液的pH。试填写表中空白(要求填写有关粒子化学式):
、Y、Z表示元素符号)。讨论上述实验过程中离子浓度的大小顺序、对应溶质的化学式和溶液的pH。试填写表中空白(要求填写有关粒子化学式):
?
| 离子浓度由大到小的顺序
| 溶质的化学式
| 溶液的pH
|
I
| c(XY+4)>c(Z—)>c(OH—)>c(H+)
| ?
| pH>7
|
II
| c(XY+4)=c(Z—)
| XY4Z、XY3·H2O
| ?
|
III
| ?
| XY4Z
| pH<7
|
IV
| c(Z—)>c(H+)>c(XY+4)> >c(OH—)
| ?
| pH<7
|
(3)B在空气中完全燃烧生成E,在一定条件下发生E与O2反应生成F。
①将0.05molE和0.03molO2放入容积为1L的密闭容器中,达到平衡,测得c(F)=0.04mol·L—1。计算该条件下反应的平衡常数K=?和E的平衡转化率?。
②已知上述反应是放热反应,当该反应处于平衡状态时,下列措施中有利于提高E平衡转化率的有?(填字母)。
A.升高温度? B.降低温度? C.增大压强? D.减小压强
参考答案:
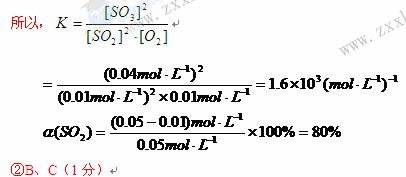
本题解析:略
本题难度:一般
2、选择题 一定温度下,在容积固定的密闭容器中进行的可逆反应:2NO2 2NO+O2,达到平衡的标志是
2NO+O2,达到平衡的标志是
①相同时间内,氧气的生成速率为n mol·L-1·s-1,NO2的生成速率为2n mol·L-1·s-1
②单位时间内生成n mol O2的同时生成2n mol的NO
③混合气体的颜色不再变化 ?④混合气体的密度保持不变
⑤混合气体的平均相对分子质量不再改变 ⑥压强不随时间变化而变化
A.①③⑤⑥
B.②③⑤
C.①③④
D.①②③④⑤⑥
参考答案:A
本题解析:在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态。颜色深浅和浓度有关系,所以③正确。①中反应速率的方向相反,且满足速率之比是相应的化学计量数之比,正确。②中反应速率的方向是相同的,不正确。密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,④不正确。混合气的平均相对分子质量是混合气的质量和混合气的总的物质的量的比值,质量不变,但物质的量是变化的,所以⑤可以说明。反应是体积减小的,所以压强也是减小的,因此⑥也可以说明,答案选A。
本题难度:一般
3、选择题 在10 L密闭容器中,1 mol A和3 mol B在一定条件下反应:A(气)+xB(气) 2C(气),2min后反应达到平衡时,测得混合气体共3.4 mol,生成0.4 mol C,则下列计算结果不正确的是
2C(气),2min后反应达到平衡时,测得混合气体共3.4 mol,生成0.4 mol C,则下列计算结果不正确的是
[? ]
A.平衡时,物质的量比A∶B∶C=2∶11∶4
B.x值等于4
C.A的转化率20%
D.B的平均反应速率为0.04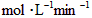
参考答案:A
本题解析:
本题难度:一般
4、填空题 将2?mol?I2(g)和1?mol?H2置于某2?L密闭容器中,在一定温度下发生反应:I2(g)+H2(g) 2HI(g) ΔH<0,并达平衡,HI的体积分数φ(HI)随时间变化如下图中曲线(Ⅱ)所示.
2HI(g) ΔH<0,并达平衡,HI的体积分数φ(HI)随时间变化如下图中曲线(Ⅱ)所示.
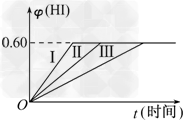
(1)达平衡时,I2(g)的物质的量浓度为________.
(2)若保持温度不变,在另一相同的2?L密闭容器中加入a?mol?I2(g)、b?mol?H2和c?mol?HI(a、b、c均大于0),发生反应,达平衡时,HI的体积分数仍为0.60,则a、b、c的关系是________.
参考答案:(1)0.55?mol/L
(2)4b+c=2a
本题解析:
本题难度:一般
5、选择题 在一定条件下,体积不变的密闭容器中,反应H2(g)+I2(g) 2HI(g)一定处于化学平衡状态的是?
2HI(g)一定处于化学平衡状态的是?
A.单位时间内有1mol H2消耗,同时有1mol I2生成
B.容器内的压强保持不变
C.H2(g)、I2(g)、HI(g)的浓度相等
D.单位时间内有1mol I-I键断裂同时有2mol H-I键形成
参考答案:A
本题解析:A 一定平衡,反应方向相反,速率相等
B 不一定平衡,因为此反应压强始终不变
C 不一定平衡,达平衡时各物质的浓度不变,不一定相等
D 不一定平衡,反应方向相同。故选A
本题难度:简单