1、实验题 工业上常回收冶炼锌废渣中的锌(含有ZnO、FeO、Fe2O3、CuO、Al2O3等杂质),并用来生产Zn(NO3)2·6H2O晶体,其工艺流程为:
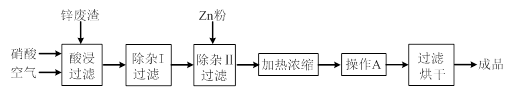
有关氢氧化物开始沉淀和沉淀完全的pH如下表:
氢氧化物
| Al(OH)3
| Fe(OH)3
| Fe(OH)2
| Cu(OH)2
| Zn(OH)2
|
开始沉淀的pH
| 3.3
| 1.5
| 6.5
| 4.2
| 5.4
|
沉淀完全的pH
| 5.2
| 3.7
| 9.7
| 6.7
| 8.0
|
?
(1)在“酸浸”步骤中,为提高锌的浸出速率,除通入空气“搅拌”外,还可采取的措施是?。
(2)在“除杂I”步骤中,需再加入适量H2O2溶液,目的是将Fe2+氧化为?,便于调节溶液的pH使铁元素转化为氢氧化物沉淀除去。为使Fe(OH)3、Al(OH)3沉淀完全,而Zn(OH)2不沉淀,应控制溶液的pH范围为 ?~?。检验Fe3+是否沉淀完全的实验操作是静置片刻,取少量上层清液,滴加?溶液,若不出现血红色,表明Fe3+沉淀完全。
(3)加入Zn粉的作用是除去溶液中的?。
参考答案:(6分)(1)适当升高反应温度(或增大硝酸浓度、将锌废渣粉碎等)
(2)Fe3+? 5.2? 5.4?KSCN?(3)Cu2+
本题解析:(1)根据外界条件对反应速率的影响可知,适当升高反应温度(或增大硝酸浓度、将锌废渣粉碎等)可提高锌的浸出速率。
(2)双氧水具有强氧化性,所以“除杂I”步骤中,需再加入适量H2O2溶液将亚铁离子氧化为铁离子,反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O;由表格中的数据可知,氢氧化锌开始沉淀的pH为5.4,氢氧化铝完全沉淀的pH为5.2,则为使Fe(OH)3、Al(OH)3沉淀完全,而Zn(OH)2不沉淀,应控制溶液的pH范围为5.2~5.4;又因为铁离子与KSCN反应出现血红色,则静置片刻,取少量上层清液,滴加KSCN溶液,若不出现血红色,表明Fe3+沉淀完全。
(3)由流程图及离子沉淀的pH可知,滤液中还含有铜离子,所以加入Zn粉的作用除去溶液中的Cu2+。
本题难度:一般
2、填空题 (9分)现有含NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂将其转化为相应的沉淀或固体,从而实现Cl-、SO42-、和NO3-的相互分离。相应的实验过程可用下图表示:
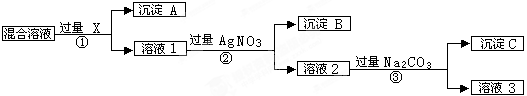
请回答下列问题:
(1)写出下列物质的化学式:试剂X _______,沉淀A_______,沉淀B?。
(2)上述实验流程中加入过量的Na2CO3的目的是(用离子方程式表示) :
?。
(3)按此实验方案得到的溶液3中肯定含有___________(填化学式,下同)杂质。为了除去该杂质,可以向溶液3中加入适量的___________ ,若要获得固体NaNO3需进行的实验操作是________________。
参考答案:(9分) (1)BaCl2[或Ba(NO3)2]? BaSO4?AgCl?(各1分)
(2)Ba2++ CO32-=BaCO3↓? 2Ag++ CO32-=Ag2CO3↓?(答两个3分,答一个1分)
(3)Na2CO3?HNO3?蒸发?(各1分)
本题解析:考查物质的分离与提纯。
(1)由于操作②中加入的是硝酸银溶液,这说明X应该是钡盐,即X是氯化钡或硝酸钡,则沉淀A是硫酸钡。而沉淀B则是氯化银。
(2)由于溶液中钡离子和银离子都是过量的,所以碳酸钠的目的是除去过量的钡离子和银离子,反应放热离子方程式分别是Ba2++ CO32-=BaCO3↓、2Ag++ CO32-=Ag2CO3↓。
(3)由于加入的碳酸钠也是过量的,所以溶液3中一定含有碳酸钠。为除去碳酸钠,可以加入适量的硝酸。而要得到硝酸钠固体,需要的实验操作是蒸发。
本题难度:一般
3、填空题 (14分)有6瓶白色固体试剂,分别是氯化钡、氢氧化钠、硫酸钠、硫酸铵、无水硫酸铜、碳酸钠,现只提供蒸馏水,通过下面的实验步骤即可签别它们。请填写下列空白:
(1)各取适量固体试剂分别加入6支试和中,加入适量蒸馏水,振荡试管,观察到的现象是 ?
被检出的物质的化学式(分子式)是??
(2)分别取未检出的溶液,往其中加入上述已检出的溶液,观察到的现象和相应的离子方程式分别为:
1支试管中有白色沉淀生成:? ?。
2支 试管中有蓝色沉生成:?、________________________。
试管中有蓝色沉生成:?、________________________。
被检出的物质的化学式(分子式)是??
(3)鉴别余下未检出物质的方法和观察到的现象
(i)分别取 (2)中能产生蓝色沉淀的两种溶液,向其中加入BaCl2溶液,有白色沉淀生成的是__________________,无沉淀生成的是_________________。
(2)中能产生蓝色沉淀的两种溶液,向其中加入BaCl2溶液,有白色沉淀生成的是__________________,无沉淀生成的是_________________。
(ii)分别取少量未检出的溶液,往其中加入NaOH溶液,无明显现象的是_____________,有刺激性气味气体产生的是___________________。
参考答案:(1)6种固体全部溶解,5支试管中得到无色溶液,1支试管中得到蓝色溶液,(2分)CuSO4 ( 1分)
1分)
(2) Ba2++SO42-=BaSO4↓; (2分)Cu2++2OH-=Cu(OH)2↓; (2分)
Ba2++SO42-=BaSO4↓; (2分)Cu2++2OH-=Cu(OH)2↓; (2分)
Cu2++CO32-=CuCO3↓; (2分)BaCl2; (1分)
(i)Na2CO3溶液, NaOH溶液。 (各1分)
(ii)Na2SO4溶液, (NH4)2SO4溶液 (各1分)
本题解析:略
本题难度:一般
4、选择题 用后面试剂除去下列各物质中少量杂质(括号内为杂质),错误的是
[? ? ]
A、苯(已烯),溴水
B、乙酸乙酯(乙酸),饱和Na2CO3
C、溴苯(溴),NaOH溶液
D、溴乙烷(乙醇),苯
参考答案:AD
本题解析:
本题难度:一般
5、选择题 现在MgCl2、AlCl3、CuCl2、FeCl3四种溶液只用一种试剂把它们区别开,这种试剂是
A.氨水
B.AgNO3
C.NaOH溶液
D.NaCl
参考答案:C
本题解析:必须添加了这一种试剂出现不同现象,就可区分开。由于CuCl2溶液浓度很大时候是绿色,浓度低时是蓝色铜盐溶液呈蓝色,FeCl3溶液呈黄色或浅黄色。MgCl2、AlCl3可用NaOH溶液区分,前者生成白色沉淀不溶解。后者加入NaOH溶液至过量会出现白色沉淀后又溶解的现象。当然CuCl2溶液和FeCl3溶液区分也可用NaOH溶液,根据生成的氢氧化物的颜色区分就更明显。
点评:鉴别离子的方法,一般是先用物理性质区分,再用化学性质区分。
本题难度:一般