1、实验题 工业上常回收冶炼锌废渣中的锌(含有ZnO、FeO、Fe2O3、CuO、Al2O3等杂质),并用来生产Zn(NO3)2·6H2O晶体,其工艺流程为:
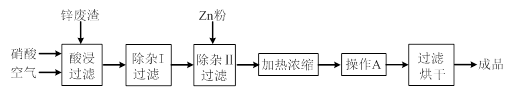
有关氢氧化物开始沉淀和沉淀完全的pH如下表:
氢氧化物
| Al(OH)3
| Fe(OH)3
| Fe(OH)2
| Cu(OH)2
| Zn(OH)2
|
开始沉淀的pH
| 3.3
| 1.5
| 6.5
| 4.2
| 5.4
|
沉淀完全的pH
| 5.2
| 3.7
| 9.7
| 6.7
| 8.0
|
?
(1)在“酸浸”步骤中,为提高锌的浸出速率,除通入空气“搅拌”外,还可采取的措施是?。
(2)在“除杂I”步骤中,需再加入适量H2O2溶液,目的是将Fe2+氧化为?,便于调节溶液的pH使铁元素转化为氢氧化物沉淀除去。为使Fe(OH)3、Al(OH)3沉淀完全,而Zn(OH)2不沉淀,应控制溶液的pH范围为 ?~?。检验Fe3+是否沉淀完全的实验操作是静置片刻,取少量上层清液,滴加?溶液,若不出现血红色,表明Fe3+沉淀完全。
(3)加入Zn粉的作用是除去溶液中的?。
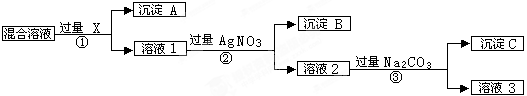
2、填空题 (9分)现有含NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂将其转化为相应的沉淀或固体,从而实现Cl-、SO42-、和NO3-的相互分离。相应的实验过程可用下图表示:
请回答下列问题:
(1)写出下列物质的化学式:试剂X _______,沉淀A_______,沉淀B?。
(2)上述实验流程中加入过量的Na2CO3的目的是(用离子方程式表示) :
?。
(3)按此实验方案得到的溶液3中肯定含有___________(填化学式,下同)杂质。为了除去该杂质,可以向溶液3中加入适量的___________ ,若要获得固体NaNO3需进行的实验操作是________________。
3、填空题 (14分)有6瓶白色固体试剂,分别是氯化钡、氢氧化钠、硫酸钠、硫酸铵、无水硫酸铜、碳酸钠,现只提供蒸馏水,通过下面的实验步骤即可签别它们。请填写下列空白:
(1)各取适量固体试剂分别加入6支试和中,加入适量蒸馏水,振荡试管,观察到的现象是 ?
被检出的物质的化学式(分子式)是??
(2)分别取未检出的溶液,往其中加入上述已检出的溶液,观察到的现象和相应的离子方程式分别为:
1支试管中有白色沉淀生成:? ?。
2支 试管中有蓝色沉生成:?、________________________。
试管中有蓝色沉生成:?、________________________。
被检出的物质的化学式(分子式)是??
(3)鉴别余下未检出物质的方法和观察到的现象
(i)分别取 (2)中能产生蓝色沉淀的两种溶液,向其中加入BaCl2溶液,有白色沉淀生成的是__________________,无沉淀生成的是_________________。
(2)中能产生蓝色沉淀的两种溶液,向其中加入BaCl2溶液,有白色沉淀生成的是__________________,无沉淀生成的是_________________。
(ii)分别取少量未检出的溶液,往其中加入NaOH溶液,无明显现象的是_____________,有刺激性气味气体产生的是___________________。
4、选择题 用后面试剂除去下列各物质中少量杂质(括号内为杂质),错误的是
[? ? ]
A、苯(已烯),溴水
B、乙酸乙酯(乙酸),饱和Na2CO3
C、溴苯(溴),NaOH溶液
D、溴乙烷(乙醇),苯
5、选择题 现在MgCl2、AlCl3、CuCl2、FeCl3四种溶液只用一种试剂把它们区别开,这种试剂是
A.氨水
B.AgNO3
C.NaOH溶液
D.NaCl