1、选择题 已知空气的平均摩尔质量为29 g·mol-1。在同温、同压下,某气体R对空气的相对密度为2,该气体是(? )
A.CH4
B.C2H4
C.C2H2
D.C4H10
参考答案:D
本题解析:根据相对密度的含义D=ρ1/ρ2,得:2=
则Mr(R)=2×29=58。
而Mr(CH4)=16,Mr(C2H4)=28,Mr(C2H2)=26,Mr(C4H10)=58。
本题难度:简单
2、填空题 已知甲、乙、丙为常见单质,A、B、C、D、X、Y、Z为常见化合物,Y的相对分子质量比Z小16,乙与丙的相对分子质量相同,B的相对分子质量比D的小2,B与X的相对分子质量相同,各物质转化关系如右图(各反应条件已略去)。
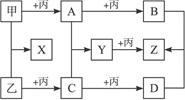
(1)丙和B的化学式分别为__________________和__________________。
(2)Y转化为Z的化学方程式为__________________________________。
(3)B与D反应的化学方程式为__________________________________。
参考答案:(1)O2? Na2O2
(2)2Na2SO3+O2====2Na2SO4
(3)2SO3+2Na2O2====2Na2SO4+O2↑
本题解析:甲、乙、丙为常见单质,且乙与丙的相对分子质量相同,Y的相对分子质量比Z小16,即Z比Y多一个氧原子。根据题中“甲 A+丙B”和“乙
A+丙B”和“乙 C
C D”两条线,应能判断出是连续氧化过程(此为该题突破点),则初步推断丙为O2,乙为S,C为SO2,D为SO3,A、B均为氧化物。
D”两条线,应能判断出是连续氧化过程(此为该题突破点),则初步推断丙为O2,乙为S,C为SO2,D为SO3,A、B均为氧化物。
又根据C+A Y,即SO2+A
Y,即SO2+A Y,则A应为碱性氧化物,可知甲为常见金属钠,A为Na2O,B为Na2O2,则X为Na2S,Y为Na2SO3,Z为Na2SO4。
Y,则A应为碱性氧化物,可知甲为常见金属钠,A为Na2O,B为Na2O2,则X为Na2S,Y为Na2SO3,Z为Na2SO4。
点评:无机推断题是高考常见题型之一,找准突破口是解无机推断题的关键,本题的突破口就是一特殊数据——Y的相对分子质量比Z小16。
本题难度:简单
3、选择题 下列叙述正确的是(? )
A.0.5 molO2中约含有6.02×1023个O原子
B.1 mol H2SO4的质量是98g/mol
C.0.5 molNa2CO3中含有1.5 mol CO32-
D.H2SO4的摩尔质量为98g
参考答案:A
本题解析:氧气分子中含有2个氧原子,所以0.5 molO2中约含有6.02×1023个O原子,选项A正确;质量的单位是g,因此选项B不正确;根据碳酸钠的化学式可知,0.5 molNa2CO3中含有05 mol CO32-,选项C不正确;摩尔质量的单位是g/mol,选项D不正确,答案选A。
本题难度:一般
4、选择题 我国科学家的最新发现解开了10年来阿伏伽德罗常数测量领域的一大难题,是对阿伏伽德罗常数测量非常有价值的贡献,若用NA表示阿伏加德罗常数的值,下列叙述不正确的是(? )
A.1mol BrCl与H2O完全反应生成氯化氢和次溴酸,转移电子数为NA
B.锌与一定浓度的浓硫酸反应,产生标准状况下SO2?和H2的混合气体22.4L时,锌失去电子数为2NA
C.1mol CO2?分子中,σ键和π键的个数都是2NA
D.常温常压下,14克乙烯、丙烯和丁烯的混合气体中氢原子数为2NA
参考答案:A
本题解析:A、Br—Cl中Br为+1价,Cl为-1价,故与水反应为非氧化还原反应,错误;B、无论生成SO2,还是H2,均转移2个电子,正确;C、O=C=O中两个σ键和两个π键,正确;D、烯烃的最简式为CH2,正确。
本题难度:一般
5、简答题 常温下,在27.5g水中溶解12.5gCuSO4?5H2O,恰好达到饱和,该溶液密度为2.0g/cm3.(保留一位小数)
求:
(1)该溶液中阴阳离子的总物质的量;
(2)该溶液中CuSO4的物质的量浓度;
(3)取出20.0ml该溶液,配成浓度为1.00mol/L的稀溶液,则稀释后溶液的体积是多少毫升?
参考答案:(1)CuSO4的物质的量为:12.5g250g/mol=0.05mol,电离产生的Cu2+和SO42-均为0.050mol,故阴阳离子的总物质的量为0.050mol+0.050mol=0.1mol,
答:阴阳离子的总物质的量为0.1mol;
(2)溶液的体积为:12.5g+27.5g2000g/L=0.02L,故CuSO4的物质的量浓度为:0.050mol0.02L=2.5mol/L,
答:CuSO4的物质的量浓度为2.5mol/L;
(3)取出溶液中含溶质硫酸铜的物质的量为:2.5mol/L×0.02L=0.05mol,
故稀释后溶液的体积为:0.05mol1.00mol/L=0.05L,即体积为50ml.
答:稀释后溶液的体积是50ml.
本题解析:
本题难度:一般