稀盐酸
参考答案:C
本题解析:原电池的构成条件是:一活动性不同的电极;二电解质溶液;三形成闭合回路;四自发进行氧化还原反应。A.具备原电池的构成条件。错误。B. 具备原电池的构成条件。错误。C.由于蔗糖是非电解质,所以不能形成闭合回路。故不能共存原电池。正确。D. 具备原电池的构成条件。错误。
本题难度:简单
2、选择题 使用氢氧燃料电池的公共汽车已在北京街头出现.某种以30%KOH溶液为电解质的氢氧燃料电池在使用时的电极反应如下:
2H2+4OH--4e-═4H2O?O2+2H2O+4e-═4OH-.下列有关该氢氧燃料电池的说法中,正确的是( )
A.H2在正极发生氧化反应
B.供电时的总反应为:2H2+O2═2H2O
C.氢氧燃料电池中H2和O2燃烧放出的热量转变为电能
D.氢氧燃料电池不仅能量转化率高,而且产物是水,属于环境友好电池
参考答案:A、由电极反应式可知,通入氢气的一极为电池的负极,发生氧化反应,故A错误;
B、电池总反应与氢气在氧气中燃烧的化学方程式一致,供电时的总反应为2H2+O2═2H2O,故B正确;
C、氢氧燃料电池是将化学能转变为电能的装置,氢气和氧气在两极上放电,没有发生燃烧,故C错误;
D、氢氧燃料电池产物是水,对环境物污染,且能量转化率高,故D正确.
故选BD.
本题解析:
本题难度:一般
3、推断题 X、Y、Z、U、V是元素周期表前四周期中的五种常见元素,其相关信息如下表:
元素
| 相关信息
| X
| 地壳中含量最多的金属,其氧化物可用作耐火材料
| Y
| 单质在常温常压下为黄绿色气体
| Z
| 常温常压下,单质是淡黄色固体,常在火山口附近沉积
| U
| 常温下单质遇浓硫酸钝化,其一种核素的质量数为56,中子数为30
| V
| 属短周期元素,原子的最外层电子数是内层电子数的2/5
|
请回答下列问题:
(1)元素X位于周期表中第 周期第 族,其离子结构示意图为 。
(2)上述元素中最高价氧化物对应的水化物酸性最强的是 (写化学式),非金属气态氢化物还原性最强的是 (写化学式)。
(3)在碱性条件下,Y的单质可与UO2-反应制备一种可用于净水的盐UO42-,该反应的离子方程式是 。
(4)我国首创的海洋电池被大规模用于海洋灯塔。该电池是以X板为负极,铂网为正极,海水为电解质溶液,电池总反应为:4X+3O2+6H2O=4X(OH)3。该电池正极反应为 。
(5)已知25℃时,Ksp[U(OH)3]=2.63×10-39,则该温度下反应U(OH)3+3H+ U3++3H2O的平衡常数K= 。 U3++3H2O的平衡常数K= 。
参考答案:(16分)
(1)三、ⅢA  (3分,每空1分) (3分,每空1分)
(2)HClO4 SiH4 (4分,每空2分)
(3)2FeO2-+ 3Cl2 + 8OH- = 2FeO42-+ 6Cl-+ 4H2O (3分)
(4)O2+4e-+2H2O=4OH-或3O2+12e-+6H2O=12OH- (3分)
(5)2.63×103 (3分,带单位计算也给分)
本题解析:(1)地壳中含量最多的金属元素是铝,则X是Al,铝原子具有283的电子层结构,位于第三周期第IIIA族;1个氯原子失去3个电子变为铝离子,则Al3+的核电荷数为13,具有28电子层结构;(2)氯气在常温常压下是黄绿色气体,则Y是氯元素,其最高价氧化物对应水化物是高氯酸,HClO4是已知酸中酸性最强的酸;硫磺在常温常压下是淡黄色固体,则Z为硫元素;由于质子数=质量数—中子数=56—30=26,则U为铁元素;短周期元素原子的内层电子数可能是2或10,最外层电子数是内层电子数的2/5,说明电子层结构为284,则V是硅元素;根据元素周期律可知,非金属性:Si<S<Cl,则单质的氧化性:Si<S<Cl2,气态氢化物的还原性:SiH4>H2S>HCl;(3)Cl2是强氧化剂,能将FeO2-氧化为FeO42-,氯由0降为-1价,铁由+3价升为+6价,根据化合价升降总数相等、电荷守恒、原子守恒可得:2FeO2-+ 3Cl2 + 8OH-= 2FeO42-+ 6Cl-+ 4H2O;(4)4Al+3O2+6H2O=4Al(OH)3,铝由0升为+3价,失去电子,发生氧化反应,说明铝作负极;氧由0降为—2价,得到电子,发生还原反应,说明氧气是正极反应物,根据电子、电荷、原子守恒可知,正极反应式为O2+4e-+2H2O=4OH-或3O2+12e-+6H2O=12OH-;(5)25℃时,Ksp[Fe(OH)3]=2.63×10-39,Kw=1.0×10-14,Fe(OH)3+3H+ Fe3++3H2O,固体和纯液体不能写入平衡常数表达式,则该反应的平衡常数K=c(Fe3+)/c3(H+)=[c(Fe3+)?c3(OH-)]/[c3(H+)?c3(OH-)]= Ksp[Fe(OH)3]/Kw3=2.63×10-39/(1.0×10-14) 3=2.63×103。 Fe3++3H2O,固体和纯液体不能写入平衡常数表达式,则该反应的平衡常数K=c(Fe3+)/c3(H+)=[c(Fe3+)?c3(OH-)]/[c3(H+)?c3(OH-)]= Ksp[Fe(OH)3]/Kw3=2.63×10-39/(1.0×10-14) 3=2.63×103。
考点:考查物质结构、元素周期律、氧化还原反应方程式的配平、书写正极反应式、根据溶度积和水的离子积计算化学平衡常数等。
本题难度:困难
4、简答题 某校开展课外研究性学习:从废旧干电池中回收碳棒、MnO2、NH4Cl、ZnCl2等物质,整个过程如下,回答有关问题:

(1)如图是干电池的基本构造图,干电池工作时正极上的反应是N +e-=NH3↑+H2↑则负极上的电极反应式是______.MnO2的作用是除去正极上的某产物,本身生成Mn2O3,该反应的化学方程式是______.
(2)锌皮和碳棒的回收:用钳子和剪子剪开回收的干电池的锌筒,将锌皮和碳棒取出,刷洗干净,将电池内的黑色粉末移入小烧杯中.
(3)氯化铵、氯化锌的提取、分离和检验.①如何从黑色粉末中提取NH4Cl和ZnCl2的晶体混合物?写出简要的实验步骤:______.
②用什么方法可将NH4Cl和ZnCl2的晶体混合物分离开?______.
③写出证明ZnCl2晶体中含Zn2+的操作步骤及实验现象:______(已知Zn(OH)2是两性氢氧化物且能溶解于氨水)
④最后剩余的黑色残渣的主要成分是MnO2,还有炭黑和有机物等,可用灼烧的方法除去杂质.该实验中需要用到的主要仪器除酒精灯外,还有______.
参考答案:(1)在锌锰干电池中,活泼金属锌为电池负极,反应式为Zn--2e-=Zn2+,MnO2生成Mn2O3,该过程中的Mn化合价降低,被还原,还原剂就是正极产物氢气,反应式为
2MnO2+H2=Mn2O3+H2O,故答案为:Zn--2e-=Zn2+;2MnO2+H2=Mn2O3+H2O;
(3)①黑色粉末既有可溶性的NH4Cl和ZnCl2,又有不溶物,所以可以采用溶解、过滤、结晶的办法得到ZnCl2和NH4Cl的混合物,
故答案为:向黑色粉末中加入一定量的蒸馏水充分搅拌溶解,过滤,将滤液蒸发浓缩、冷却结晶,再过滤,所得晶体即为ZnCl2和NH4Cl的混合物;
②NH4Cl具有热不稳定性,而且稳定性降低时又能马上化合生成氯化铵,因此可以采用加热方法,故答案为:加法;
③Zn2+中不管是先滴加强碱性或弱碱性溶液都能先出现白色沉淀,后沉淀溶解,
故答案为:取少量ZnCl2于试管中溶解,将溶液平均分为两等份,分别滴加足量NaOH溶液和氨水,两支试管中均为先后白色沉淀生成,后沉淀又溶解;
④灼烧操作需要坩埚,转移坩埚需要坩埚钳,坩埚需要放置在三脚架或铁架台的铁圈上的泥三角中,灼烧过程中要用玻璃棒搅拌,
故答案为:坩埚、坩埚钳、三脚架、泥三角、玻璃棒.
本题解析:
本题难度:一般
5、简答题 由铜片、锌片和足量稀H2SO4组成的原电池中,若锌片只发生电化学腐蚀,一段时间后某极产生3.36L(标准状况)的气体.问:
(1)负极是______(填“锌”或“铜”),发生______反应(填“氧化”或“还原”).
(2)正极的电极反应为______
(3)产生这些气体共需转移电子______mol.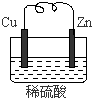
参考答案:(1)Zn、Cu、硫酸构成的原电池中,金属锌做负极,发生失电子的氧化反应,故答案为:锌;氧化;
(2)Zn、Cu、硫酸构成的原电池中,正极上是电解质中的氢离子得电子的过程,电极反应式为:2H++2e-=H2↑,故答案为:2H++2e-=H2↑;
(3)根据电极反应:2H++2e-=H2↑,当产生3.36L(标准状况)即0.15mol的气体时,转移电子为0.3mol,故答案为:0.3.
本题解析:
本题难度:一般
|