1、选择题 有A、B、C、D四种金属。将A与B用导线连接起来,浸入电解质溶液中,B不易腐蚀。将A、D分别投入等浓度盐酸中,D比A反应剧烈。将铜浸入B的盐溶液里,无明显变化。如果把铜浸入C的盐溶液里,有金属C析出。据此判断它们的金属活动性由强到弱的顺序是?
[? ]
A.D、C、A、B
B.D、A、B、C?
C.D、B、A、C?
D.B、A、D、C
参考答案:B
本题解析:
本题难度:一般
2、选择题 在盛有稀H2SO4的烧杯中插入用导线连接的锌片和铜片,下列叙述正确的是
[? ]
A.正极附近的SO4 2-离子浓度逐渐增大
B.电子通过导线由铜片流向锌片
C.溶液的pH逐渐变小
D.铜片上H2有逸出
参考答案:D
本题解析:
本题难度:一般
3、填空题 碘在科研与生活中有重要应用。某兴趣小组用0.50mol/LKI、0.2%淀粉溶液、0.20mol/L
K2S2O8、0.10mol/LNa2S2O3等试剂,探究反应条件对化学反应速率的影响。已知:
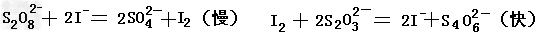
(1)向KI、Na2S2O3与淀粉的混合溶液中加入一定量的K2S2O8溶液,当溶液中的__________耗尽后,溶液颜色将由无色变成为蓝色。为确保能观察到蓝色,S2O32-与S2O82-初始的物质的量需满足的关系为:n(S2O32-):n(S2O82-)_______。
(2)为探讨反应物浓度对化学反应速率的影响,设计的实验方案如下表
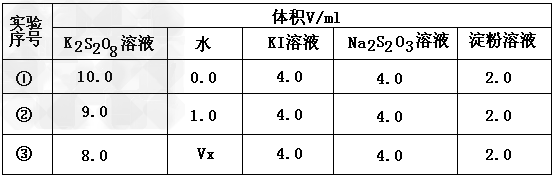
表中Vx=____mL,理由是___________________。
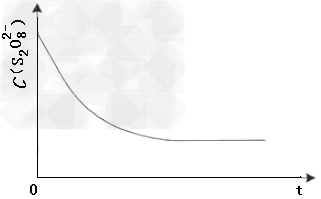
(3) 已知某条件下,浓度c(S2O82-)~反应时间t的变化曲线如图,若保持其他条件不变,请在答题卡坐标图中,分别画出降低反应温度和加入催化剂时c(S2O82-)~t的变化曲线示意图(进行相应的标注)
(4) 碘也可用作心脏起搏器电源—锂碘电池的材料。该电池反应为:
2Li(s)+I2(s)=2LiI(s)△H
已知:4Li(s)+O2(g)=2Li2O(s)△H1
4LiI(s)+O2(g)=2I2(s)+2Li2O(s)△H2
则电池反应的△H=_______________;碘电极作为该电池的___________极。
参考答案:(1)Na2S2O3,<2
(2)2;保证反应物K2S2O8浓度改变,而其他的不变,才到达实验目的。(3)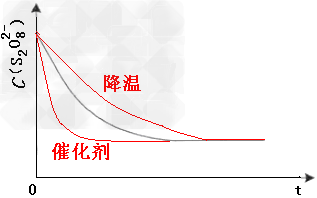 (4)(△H1-△H2)/2;负极
(4)(△H1-△H2)/2;负极
本题解析:
本题难度:一般
4、填空题 原电池是一种______装置.电子的流动方向是从______极到______极;电流方向是从______极到______极.电工操作中规定,不能把铜线和铝线拧在一起连接线路,这是因为在潮湿的空气中,铜与铝接触形成______,其中铝做______,很快被腐蚀.
参考答案:原电池是一种将化学能转化为电能的装置,在原电池中,电子的流动方向是从负极沿着导线流向正极,电流方向和电子流向相反,即从正极流向负极,铜、铝、潮湿的空气构成的原电池中,金属铝做负极,易被腐蚀.故答案为:将化学能转变为电能的;负;正;正;负;原电池;负极.
本题解析:
本题难度:一般
5、填空题 (6分)现有如下两个反应:
A.NaOH + HCl =" NaCl" + H2O B.2FeCl3+Cu =2FeCl2+CuCl2
(1)根据两反应本质, 判断能设计成原电池的是:_______,(填序号 )。
(2)不能的, 说明其原因_______________________________________________;(2分)
(3)如果可以, 写出负极材料及其电极反应式, 电解质溶液名称:
负极材料________,电极反应式_______________,电解质溶液名称____________,
参考答案:(6分)⑴ B
⑵(A)的反应为非氧化还原反应, 没有电子转移
⑶ 铜, Cu-2e- =Cu2+, 氯化铁溶液 +(每空1分)
本题解析:(1)原电池中的化学反应是氧化还原反应,所以只有B是氧化还原反应,可设计成原电池;
(2)A反应是非氧化还原反应,没有电子的转移,不能构成原电池;
(3)B中发生氧化反应的是Cu,所以Cu作负极,正极材料是比Cu不活泼的金属或石墨即可;电极反应式是Cu-2e- =Cu2+,溶液中的铁离子发生还原反应生成亚铁离子,所以电解质溶液是氯化铁溶液。
考点:考查原电池的构成条件,电极反应式、电极材料、电解质溶液的判断
本题难度:一般