1、填空题 如图是传统的工业生产金属铝的基本流程图。
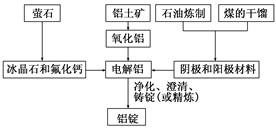
请回答:
(1)金属铝常用来制造容器,但铝制餐具不宜用来蒸煮或长时间存放酸性、碱性等食物,写出铝与氢氧化钠溶液反应的离子方程式:_____________________________________。
石油炼制和煤的干馏产品________(填物质名称)作电解铝的阴极和阳极材料。
(2)在冶炼过程中,阳极材料需要定期进行更换,原因是该极材料不断被消耗,产生这种现象的原因是____________________________________(用化学方程式表示)。
(3)工业上通过电解熔融的MgCl2制取金属镁,电解反应方程式为________________。镁和铝都是活泼金属,为什么在电解冶炼过程中,一个用氯化物,一个用氧化物,请说明理由。________________________________________________。
参考答案:(1)2Al+2OH-+2H2O=2AlO2-+3H2↑ 石墨(或碳)
(2)2C+O2 2CO
2CO
(3)MgCl2(熔融) Mg+Cl2↑ MgO的溶点太高,而MgCl2的熔点较低,熔化时MgCl2能发生电离而导电;AlCl3是共价化合物,熔化时不能发生电离
Mg+Cl2↑ MgO的溶点太高,而MgCl2的熔点较低,熔化时MgCl2能发生电离而导电;AlCl3是共价化合物,熔化时不能发生电离
本题解析:(1)Al与强碱溶液作用得到偏铝酸盐与氢气,故反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑。
(2)电解过程中阳极产生氧气,在高温下氧气与电极材料(石墨)反应生成CO。
本题难度:一般
2、选择题 下列物质中,既可与盐酸反应,又可与氢氧化钠溶液反应的是( )
①Na2SiO3?②AlCl3?③NH4HCO3?④Al2O3?⑤NaHSO4?
A.③④
B.①④⑤
C.②③
D.②④
参考答案:A
本题解析:正确答案:A
①Na2SiO3只与盐酸反应?②AlCl3只与氢氧化钠反应?③NH4HCO3既可与盐酸反应,又可与氢氧化钠溶液反应?④Al2O3既可与盐酸反应,又可与氢氧化钠溶液反应?⑤NaHSO4只与氢氧化钠反应
本题难度:简单
3、选择题 下列物质中既能与盐酸又能与氢氧化钠溶液反应且均有气体生成的是( )
A.Al
B.NH4HCO3
C.Al(OH)3
D.Al2O3
参考答案:A、金属铝和盐酸反应生成氢气,2Al+6H+=2AI3++3H2↑;和氢氧化钠溶液反应生成氢气2Al+2NaOH+2H2O=2NaAIO2+3H2↑,故A正确;
B、NH4HCO3和盐酸反应生成二氧化碳,NH4HCO3+HCI=NH4CI+H20+CO2↑,与氢氧化钠溶液反应生成氨气,NH4HCO3+2NaOH=NH3↑+2H20+Na2CO3,故B正确;
C、Al(OH)3溶于强酸强碱,与盐酸反应,Al(OH)3+3H+=AI3++3H2O,与氢氧化钠溶液反应,Al(OH)3+OH-=AIO2-+2H2O,故C错误;
D、Al2O3溶于强酸强碱,与盐酸反应,Al2O3+6H+=2AI3++3H2O,与氢氧化钠溶液反应Al2O3+2OH-=2AIO2-+H2O,故D错误;
故选AB.
本题解析:
本题难度:一般
4、填空题 (21分)有A、B、C、D、E五种化合物,其中A、B、C、D是含铝元素的化合物,F是一种气体,标准状况下相对于空气的密度为1.103。它们之间有下列的转化关系:
①A+NaOH→D+H2O?②B→A + H2O?③C+ NaOH→B+NaCl?④E+ H2O→NaOH+F
+ H2O?③C+ NaOH→B+NaCl?④E+ H2O→NaOH+F
⑴写出A、B、C、D的化学式:
A?,B?,C?,E? ?。
?。
⑵写出①③④的离子方程式:
①?,?
③?,
④?。
参考答案:略
本题解析:略
本题难度:一般
5、选择题 质量相同的两份铝分别和足量的NaOH溶液和稀HCl反应,相同条件下产生H2的体积比是?
A.1:2
B.1:3
C.3:2
D.1:1
参考答案:D
本题解析:
解:正确答案D。
2Al+6HCl=2AlCl3+3H2↑
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
由两个方程式可知:每2molAl获得3molH2,质量相同的两份铝分别和足量的NaOH溶液和稀HCl反应,相同条件下产生H2的体积比是1:1.
本题难度:一般