1、选择题 关于氧化还原反应,下列说法正确的是( )
①氧化剂发生氧化反应;②氧化剂具有氧化性;③氧化反应的本质是化合价升降;④物质所含元素化合价变化是判断氧化还原反应的依据;⑤氧化还原反应的任一反应物不是氧化剂就是还原剂.
A.②④
B.②③④
C.①②④
D.①②④⑤
参考答案:①氧化剂得电子发生还原反应,故错误;
②氧化剂具有氧化性,在反应中被还原,故正确;
③氧化还原反应的本质是电子的转移,故错误;
④物质所含元素化合价变化是判断氧化还原反应的依据,本质是电子的转移,故正确;
⑤氧化还原反应中有的物质可能既不是氧化剂又不是还原剂,故错误;
故选A.
本题解析:
本题难度:简单
2、简答题 .用KMnO4氧化密度为1.19g/cm3,溶质的质量分数为36.5%的?盐酸.反应方程式如下:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O
(1)用双线桥法标出上述反应电子得失数目.
(2)求所用盐酸的物质的量浓度.
(3)15.8gKMnO4能使多少克HCl发生上述反应?产生的Cl2在标准状况下的体积为多少?
参考答案:(1)反应中高锰酸钾为氧化剂,浓盐酸为还原剂,Mn元素的化合价+7→+2,和Cl元素的化合价-1→0,反应中氧化剂和还原剂得失电子数目相等,
答:双线桥法标出反应中电子得失数目为
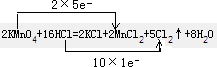
;
(2)c(HCl)=1000ρwM=1000×1.19×36.5%36.5=11.9(mol?L-1),
答:所用盐酸的物质的量浓度为11.9mol?L-1;
(3)设15.8gKMnO4能同xgHCl发生反应,生成标准状况下yLCl2.
? 2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O
2×158?g?16×36.5?g?5×22.4?L
?15.8?g? x?g? y?L
则?x=16×36.5×15.82×158=29.2?(g),
y=5×22.4L×15.8g2×158g=5.6L.
答:15.8gKMnO4能使29.2克HCl发生上述反应;产生的Cl2在标准状况下的体积为5.6L.
本题解析:
本题难度:一般
3、选择题 关于反应?MnO2+4HCl(浓)=MnCl2+Cl2+2H2O?的说法中,正确的是( )
A.氧化剂:MnO2,氧化产物是:MnCl2
B.还原剂:MnO2,还原产物是:MnCl2
C.氧化剂:MnO2,氧化产物是:Cl2
D.还原剂:HCl还原产物:Cl2
参考答案:根据化学方程式,MnO2中的锰元素在反应前后化合价降低从+4~+2,得电子、做氧化剂、被还原、发生还原反应、得还原产物MnCl2;HCl中的氯元素在反应前后化合价升高从-1~0,失电子、做还原剂、被氧化、发生氧化反应、得氧化产物Cl2,所以C正确,A、B、D错误.
故选C.
本题解析:
本题难度:一般
4、选择题 已知?6FeSO4+2KNO3+4H2SO4═K2SO4+3Fe2(SO4)3+2NO↑+4H2O,下列判断正确的是( )
A.上述反应中KNO3是还原剂
B.反应中H2SO4是氧化剂
C.上述反应中Fe2+既体现了氧化性又体现了还原性
D.当产生0.1mol NO时,则上述反应转移电子的物质的量为0.3mol
参考答案:A、因KNO3中N元素的化合价降低,则KNO3为氧化剂,故A错误;
B、因H2SO4中各元素的化合价在反应前后都不变,则不作氧化剂,故B错误;
C、因反应中只有Fe元素的化合价升高,则上述反应中Fe2+只体现了还原性,故C错误;
D、生成0.1molNO时,则上述反应转移电子的物质的量为0.1mol×(5-2)=0.3mol,故D正确;
故选D.
本题解析:
本题难度:简单
5、简答题 氯、溴、碘同属于周期表中的ⅦA族,在上个世纪,人们很早就制得高碘酸及其盐,但得不到含+7价溴的化合物,1968年,化学家用发现不久的XeF2和KBrO3首先制得纯净的KBrO4晶体.
(1)高碘酸盐(IO65-)能在酸性条件下将Mn2+氧化为MnO4-(本身被还原成I03-),其反应平稳而迅速,写出离子反应方程式:______.
(2)在25℃,已知pH=2的高碘酸溶液与pH=12的NaOH溶液等体积混合,所得混合液显酸性;0.01mol-L-1的碘酸或高锰酸溶液与pH=12的NaOH溶液等体积混合,所得混合液显中性.则高碘酸是______;高锰酸是______(填“强酸”或“弱酸”).
(3)写出XeF2和含KOH、KBrO3的水溶液反应得到KBrO4的离子方程式______.
参考答案:(1)高碘酸根离子得电子作氧化剂,锰离子失电子作还原剂,在酸性条件下高锰酸根离子和锰离子发生氧化还原反应生成碘酸根离子和高锰酸根离子、水,所以离子方程式为5IO65-+2Mn2++14H+=5IO3-+2MnO4-+7H2O.
故答案为:5IO65-+2Mn2++14H+=5IO3-+2MnO4-+7H2O.
(2)pH=2的高碘酸溶液与pH=12的NaOH溶液中氢离子浓度和氢氧根离子的浓度相等,氢氧化钠是强碱,等体积混合时,若溶液呈中性,说明氢离子和氢氧根离子恰好反应,高碘酸是强酸,但实际上混合溶液呈酸性,这说明高碘酸又电离出部分氢离子,所以高碘酸是弱酸.
pH=12的NaOH溶液氢氧根离子的浓度为0.01mol?L-1,当0.01mol?L-1的碘酸或高锰酸溶液与pH=12的NaOH溶液等体积混合时,溶液呈中性,说明碘酸或高锰酸中氢离子的物质的量与氢氧根离子的物质的量相等,溶液的体积相等,氢氧化钠是强碱,所以高锰酸全部电离属于强电解质,所以是强酸.
故答案为:高碘酸是弱酸;高锰酸是强酸.
(3)根据KBrO3和KBrO4中的溴的化合价分别是+5价、+7价,所以由KBrO3生成KBrO4,KBrO3失电子作还原剂,所以XeF2得电子作氧化剂,F元素的非金属性最强,所以只能以化合态存在,只能是Xe元素得电子生成单质Xe,同时有水生成,所以离子方程式为XeF2+2OH-+BrO3-=BrO4-+Xe+2F-+H2O.
故答案为:XeF2+2OH-+BrO3-=BrO4-+Xe+2F-+H2O.
本题解析:
本题难度:一般