1、选择题 下列表示对应化学反应的离子方程式正确的是
A.冷的氢氧化钠溶液中通入氯气:Cl2+OH-= ClO-+Cl-+H2O
B.碳酸氢钠溶液中滴入氢氧化钠溶液:HCO3-+OH–=CO32-+ H2O
C.在醋酸溶液中加入Na2CO3溶液:CO32-+2H+=CO2↑+H2O
D.三氯化铁溶液与氢氧化钡溶液反应:FeCl3+3OH-=Fe(OH)3↓+3Cl-
参考答案:B
本题解析:A、氯气与水反应生成的次氯酸是弱电解质:Cl2+H2O═H++Cl-+HClO,故A错误;B、正确;C、醋酸是弱电解质,2CH3COOH+CO32―=2CH3COO―+H2O+CO2↑,C错;D、FeCl3是强电解质,Fe3++3OH―="Fe" (OH)3 ↓,D错,选B。
本题难度:一般
2、选择题 下列离子方程式正确的是( )
A.NaHSO3溶液中投入过氧化钠粉末:2HSO3-+2Na2O2═2SO32-+O2↑+4Na++H2O
B.惰性电极电解氯化钠溶液:2Cl-+2H2O
Cl2↑+H2↑+2OH-
C.氢氧化钙溶液与过量碳酸氢钠溶液反应:HCO3-+Ca2++OH-═CaCO3↓+H2O
D.向溴化亚铁溶液中滴加少量氯水:2Br-+Cl2═Br2+2Cl-
参考答案:A.NaHSO3溶液中投入过氧化钠粉末,HSO3-被氧化为SO42-,反应实质错误,故A错误;
B.惰性电极电解氯化钠溶液的离子反应为2Cl-+2H2O?电解?.?Cl2↑+H2↑+2OH-,故B正确;
C.氢氧化钙溶液与过量碳酸氢钠溶液反应的离子反应为2HCO3-+Ca2++2OH-═CaCO3↓+2H2O+CO32-,故C错误;
D.向溴化亚铁溶液中滴加少量氯水的离子反应为2Fe2++Cl2═2Cl-+2Fe3+,故D错误;
故选B.
本题解析:
本题难度:简单
3、简答题 如图所示与对应的叙述相符的是( )
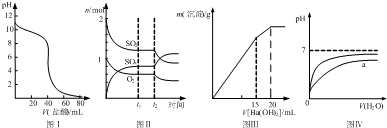
A.图Ⅰ表示盐酸滴加到0.1?mol/L某碱溶液得到的滴定曲线,用已知浓度盐酸滴定未知浓度该碱时最好选取酚酞作指示剂
B.图Ⅱ表示一定条件下进行的反应2SO2+O2?2SO3各成分的物质的量变化,t2时刻改变的条件可能是缩小容器体积
C.图Ⅲ表示某明矾溶液中加入Ba(OH)2溶液,沉淀的质量与加入Ba(OH)2溶液体积的关系,在加入20?mL?Ba(OH)2溶液时铝离子恰好沉淀完全
D.图Ⅳ表示pH相同的盐酸与醋酸中分别加入水后溶液pH的变化,其中曲线a对应的是盐酸
参考答案:A.图Ⅰ表示的碱溶液pH<13,说明是弱碱溶液;反应后是强酸弱碱溶液,宜选择酸性变色突变的甲基橙,而不是碱性变色突变的酚酞作指示剂,故A错误;
B.图Ⅱ表示的各自量不变,平衡正向移动,可能是加压过程,故B正确;
C.明矾溶液中加入Ba(OH)2溶液的拐点方程式是2KAl(SO4)2+3Ba(OH)2=2Al(OH)3↓+3BaSO4↓+K2SO4、KAl(SO4)2+2Ba(OH)2═KAlO2+2BaSO4↓+2H2O,同样2mol KAl(SO4)2,按前者反应产生的沉淀质量是(2×78+3×233)g=855g,按后者反应产生的沉淀质量是4×233g=932g,图象形态正确,20mL Ba(OH)2溶液时,铝离子恰好变成AlO2-,故C错误;
D.盐酸与醋酸的稀释,pH变化大的是盐酸,故D错误.
故选B.
本题解析:
本题难度:一般
4、选择题 下列离子方程式中正确的是( )
A.铁片插入硝酸铜溶液Fe+Cu2+→Fe3++Cu
B.石灰石和盐酸反应CO32-+2H+→CO2↑+H2O
C.氢氧化镁与稀盐酸反应Mg(OH)2+2H+→Mg2++2H2O
D.硫酸与氢氧化钡溶液反应H++OH-→H2O
参考答案:A.铁片插入硝酸铜溶液,反应产物错误,应该为亚铁离子,正确的离子方程式为:Fe+Cu2+=Fe2++Cu,故A错误;
B.石灰石和盐酸反应,碳酸钙应该保留化学式,正确的离子方程式为:CaCO3+2H+=Ca2++H2O+CO2↑,故B错误;
C.氢氧化镁与盐酸反应生成氯化镁和水,反应的离子方程式为:Mg(OH)2+2H+=Mg2++2H2O,故C正确;
D.稀硫酸与氢氧化钡溶液反应生成硫酸钡沉淀和水,正确的离子方程式为:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O,故D错误;
故选C.
本题解析:
本题难度:一般
5、选择题 在1L含0.1mol?NaAlO2和0.1mol?Ba(OH)2的混合溶液中,逐滴加入浓度为0.1mol/L的H2SO4溶液,下列图象中能表示反应产生沉淀的物质的量与加入硫酸溶液体积之间关系的是( )
A.

B.

C.
D.

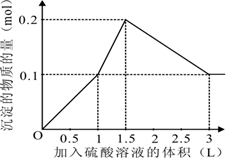
参考答案:在1L含0.1mol?NaAlO2和0.1mol?Ba(OH)2的混合溶液中n(NaAlO2)=0.1mol,n[Ba(OH)2]=0.1mol,向该混合溶液中加入H2SO4溶液,首先发生反应Ba(OH)2+H2SO4=BaSO4↓+2H2O,Ba(OH)2反应完毕,继续加入H2SO4溶液,再发生反应AlO2-+H++H2O=Al(OH)3↓,AlO2-反应完毕,沉淀达最大,继续加入H2SO4溶液,发生反应Al(OH)3+3H+=Al3++3H2O,沉淀减少,Al(OH)3反应完毕,最后为BaSO4沉淀,继续加入H2SO4溶液,沉淀的量不变.
第一阶段:由发生反应Ba(OH)2+H2SO4=BaSO4↓+2H2O可知,Ba(OH)2反应完毕,需加入0.1molH2SO4,H2SO4溶液的体积为0.1mol0.1mol/L=1L,生成沉淀n(BaSO4)=0.1mol;
第二阶段:由发生反应AlO2-+H++H2O=Al(OH)3↓可知,0.1molAlO2-反应完毕,该阶段需加入0.05molH2SO4,H2SO4溶液的体积为0.05mol0.1mol/L=0.5L,该阶段生成沉淀n[Al(OH)3]=0.1mol,但加入相同体积的硫酸,该阶段比第一阶段生成沉淀的多,为第一阶段的2倍;
第三阶段:由发生反应Al(OH)3+3H+=Al3++3H2O可知,沉淀减少,0.1molAl(OH)3完全溶解,该阶段需加入0.1mol×32=0.15molH2SO4,H2SO4溶液的体积为0.15mol0.1mol/L=1.5L,沉淀n(BaSO4)=0.1mol.
由上述分析可知:
第一阶段产生沉淀n(BaSO4)=0.1mol,加入H2SO4溶液的体积为1L;
第二阶段又生成沉淀n[Al(OH)3]=0.1mol,此时沉淀总量为0.2mol,该阶段加入H2SO4溶液的体积为0.1L,此时加入H2SO4溶液的总体积为1.5L;
第三阶段0.1molAl(OH)3完全溶解,此时沉淀n(BaSO4)=0.1mol,该阶段加入H2SO4溶液的体积为1.5L,此时加入H2SO4的总体积为3L.
故沉淀的量与H2SO4溶液体积关系图为:
,
故选A.
本题解析:
本题难度:一般