1、实验题 (18分)以铝灰(主要成分为Al、Al2O3,另有少量CuO、SiO2、FeO和Fe2O3杂质)为原料,可制得液体聚合氯化铝 [Alm(OH)nCl3m—n],生产的部分过程如下图所示(部分产物和操作已略去)。
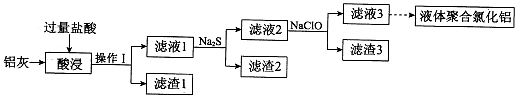
(1)Al2O3与盐酸反应的离子方程式是_____________________。
(2)滤渣I是__________。滤渣2为黑色,该黑色物质的化学式是___________。
(3)向滤液2中加入NaClO溶液至不再产生红褐色沉淀,此时溶液的pH约为3.7。其中NaClO的作用是___________。该过程发生反应的离子方程式为______________。
(4)将滤液3的pH调至4.2~4.5,利用水解反应得到液体聚合氯化铝。该反应的化学方程式为_____________________。
(5)Na2S溶液呈碱性的原因是________(用离子方程式表示)。该溶液中c(Na+)=________。
参考答案:(1)Al2O3+6H+ =2 Al3++3H2O
(2)SiO2 CuS
(3)将Fe2+氧化为Fe3+,使Fe3+转化为Fe(OH)3
2Fe2++ClO—+2H+=2Fe3++Cl—+H2O、Fe3++3ClO—+3H2O=Fe(OH)3↓+3HClO(3分)
(4)mAlCl3+nH2O = Alm(OH)nCl3m-n+nHCl (写“ ”也正确)
”也正确)
(5)S2—+H2O HS—+OH—
HS—+OH—
2c(S2—) + 2c(HS—) + 2c(H2S)或2c(S2—) + c(HS—) + c(OH—) - c(H+) (3分)
本题解析:分析题给信息和流程知,铝灰加过量盐酸酸浸发生的反应为2Al+6H+ =2Al3++3H2、Al2O3+6H+ =2Al3++3H2O、CuO+2H+==Cu2+ +H2O、FeO+2H+==Fe2+ +H2O、Fe 2O3 + 6H+="=2" Fe 3+ + 3H2O,经操作Ⅰ过滤得滤渣1为SiO2,滤液1为氯化铝、氯化铁、氯化铜、氯化亚铁和盐酸的混合液,向其中加入硫化钠生成黑色氯化铜沉淀,过滤得滤渣2为硫化铜,滤液2为氯化铝、氯化铁和氯化亚铁的混合液,向其中加入次氯酸钠,将Fe2+氧化为Fe3+,使Fe3+转化为Fe(OH)3,滤液3可制得液体聚合氯化铝[Alm(OH)nCl3m—n]。(1)Al2O3与盐酸反应生成氯化铝和水,离子方程式是Al2O3+6H+ =2 Al3++3H2O ;(2)滤渣I是SiO2,滤渣2为黑色,该黑色物质的化学式是CuS;(3)向滤液2中加入NaClO溶液至不再产生红褐色沉淀,此时溶液的pH约为3.7。 其中NaClO的作用是将Fe2+氧化为Fe3+,使Fe3+转化为Fe(OH)3 。该过程发生反应的离子方程式为2Fe2++ClO—+2H+=2Fe3++Cl—+H2O、Fe3++3ClO—+3H2O=Fe(OH)3↓+3HClO;(4)将滤液3的pH调至4.2~4.5,利用水解反应得到液体聚合氯化铝。该反应的化学方程式为mAlCl3+nH2O = Alm(OH)nCl3m-n+nHCl;(5)硫化钠为强碱弱酸盐,硫离子分步水解,以第一步水解为主,Na2S溶液呈碱性的原因是S2—+H2O HS—+OH—。该溶液中根据物料守恒有c(Na+)=2c(S2—)+2c(HS—)+2c(H2S),根据电荷守恒有2c(S2—)+c(HS—)+c(OH—)-c(H+)。
HS—+OH—。该溶液中根据物料守恒有c(Na+)=2c(S2—)+2c(HS—)+2c(H2S),根据电荷守恒有2c(S2—)+c(HS—)+c(OH—)-c(H+)。
考点:以液体聚合氯化铝的化工生产流程为载体考查物质的分离、提纯,化学方程式、离子方程式的书写及盐类水解原理的应用。
本题难度:困难
2、选择题 下列离子或分子能够在指定的分散系中大量共存的是
A.c(H+)=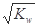 mol/L的溶液中:NO3—、NH4+ 、K+、Na+
mol/L的溶液中:NO3—、NH4+ 、K+、Na+
B.苯酚钠溶液中:HCO3—、Na+、K+、CH3COO-
C.铁与稀硫酸反应制取H2后的溶液中:K+、AlO2—、SO42—、Br-
D.新鲜的空气:SO2、NO、N2、NH3
参考答案:B
本题解析:A、c(H+)=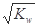 mol/L的溶液呈中性,而NH4+ 水解呈酸性,不能大量共存,错误;B、给定条件下,组内离子间不反应,能大量共存,正确;C、铁与稀硫酸反应制取H2后的溶液中,Fe2+和AlO2—发生水解相互促进的反应,不能大量共存,错误;D、新鲜的空气中,2NO+O2
mol/L的溶液呈中性,而NH4+ 水解呈酸性,不能大量共存,错误;B、给定条件下,组内离子间不反应,能大量共存,正确;C、铁与稀硫酸反应制取H2后的溶液中,Fe2+和AlO2—发生水解相互促进的反应,不能大量共存,错误;D、新鲜的空气中,2NO+O2 2NO2,不能大量共存,错误。
2NO2,不能大量共存,错误。
本题难度:一般
3、选择题 在下列给定条件的溶液中,一定能大量共存的离子组是( )
A.在水电离出的c(H+)=1×10-12mol/L的溶液中:NH4+、Na+、SO42-、Cl-
B.能使pH试纸呈红色的溶液:Na+、NH4+、I-、NO3-
C.NH4Cl溶液:K+、Na+、SO42-、AlO2-
D.
=0.1?mol/L的溶液:Na+、K+、SiO32-、NO3-
参考答案:A.水电离出的c(H+)=1×10-12mol/L的溶液,为酸或碱溶液,酸溶液中该组离子不反应能共存,但碱溶液中NH4+、OH-结合生成弱电解质,而不能共存,故A不选;
B.使pH试纸呈红色,显酸性,I-、NO3-发生氧化还原反应而不能共存,故B不选;
C.NH4Cl溶液铵根离子水解,而AlO2-促进铵根离子的水解,则不能共存,故C不选;
D.KwC(H+)=0.1?mol/L的溶液,c(OH-)=0.1mol/L,溶液显碱性,该组离子在碱性溶液中不反应,则能够共存,故D选;
故选D.
本题解析:
本题难度:简单
4、选择题 下列离子组一定能大量共存的是
[? ]
A. 甲基橙呈红色的溶液中:I-、Cl-、NO3-、Na+
B. 石蕊呈蓝色的溶液中 :Na+、AlO2-、NO3-、HCO3-
C. 含大量OH-的溶液中:CO32-、Cl-、F-、K+
D. 含大量Al3+的溶液中:K+、Na+、NO3-、ClO-
参考答案:C
本题解析:
本题难度:一般
5、选择题 下列各组离子一定能大量共存的是
A.在无色溶液中:NH4+、Fe2+、SO42-、CO32-
B.在含大量Ba2+的溶液中:NH4+、Na+、Cl-、OH-
C.在强碱溶液中:Na+、K+、Cl-、HSO3-
D.在pH =1的溶液中:K+、Na+、Cl-、CH3COO-