1、选择题
A.FeO
B.Fe2O3?
C.Fe3O4
D.FeO、Fe2O3?
参考答案:B
本题解析:FexOy+yCO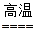 xFe+yCO2?
xFe+yCO2?
(56x+16y) g?y mol?
0.4 g? ?mol
?mol
得:x∶y=2∶3?
本题难度:一般
2、选择题 在FeCl3、CuCl2混合溶液中,加入一定量的铁屑,反应完全后将固体滤出,下列说法中正确的是( )
A.若滤出的固体中只有铜,则溶液中一定含有的阳离子是Fe2+,一定不含Cu2+
B.若滤出的固体中只有铜,则溶液中一定含有的阳离子是Fe2+,可能含有Cu2+和Fe3+
C.若滤出的固体中只有铜,则溶液中一定含有的阳离子是Fe3+和Fe2+,一定不含Cu2+
D.若滤出的固体中含有铁和铜,则溶液中一定含有的阳离子是Fe2+,一定不含Cu2+和Fe3+
参考答案:D
本题解析:由于先发生反应:Fe+2FeCl3=3FeCl2,后发生反应:Fe+CuCl2=FeCl2+Cu。若滤出的固体中只有铜,则溶液中一定含有的阳离子是Fe2+,可能含有Cu2+,一定不含Fe3+;若滤出的固体中含有铁和铜,则溶液中一定含有的阳离子是Fe2+,一定不含Cu2+和Fe3+,故A、B、C项均错误,D项正确。
本题难度:一般
3、填空题 (12分)工业上利用硫酸渣(含Fe2+、Fe3+的硫酸盐及少量CaO和MgO)制备高档颜料铁红(Fe2O3)和回收(NH4)2SO4,具体生产流程如下:

(1)在废渣溶解时需要使用酸,应选用__________,为了提高废渣的浸取率,可采用的措施有哪些?
_____________________________________________________________(至少写出两点)。
(2)物质A是一种氧化剂,工业上最好选用_____________(供选择使用的有:空气、Cl2、MnO2),其理由是?(至少写出两点)。
(3)“结晶”反应的化学方程式为__________________________________________________。
(4)上述生产流程中多处采用了过滤操作,实验室中完成相应的操作需要用到的玻璃仪器有烧杯及____________________________________________。
参考答案:(1)硫酸,将废渣粉碎、加热、搅拌等。?
(2)空气,原料来源容易、成本低、不产生污染、不引入杂质。
(3)3Fe2(SO4)3+12NH3·H2O=(NH4)2Fe6(SO4)4(OH)12↓+5(NH4)2SO4。
(4)玻璃棒、漏斗。
本题解析:通过流程图可以看出生成的是硫酸盐,所以溶解废渣时要用硫酸。从影响速率的因素考虑应该采用废渣粉碎、加热、搅拌等方法。空气是一种最廉价且无污染的氧化剂,所以选空气。根据图示可知,结晶过程发生的反应为3Fe2(SO4)3+12NH3·H2O=(NH4)2Fe6(SO4)4(OH)12↓+5(NH4)2SO4。过滤操作总需要用到的玻璃仪器有烧杯、玻璃棒和漏斗。
点评:近几年,工艺流程题已成为各地高考的热点试题,其具有阅读量大、信息新颖、情境陌生、流程复杂等特点。考生对此往往就会有畏惧感,解题时不知从何处入手突破,所以这类试题的得分率一般不是很高。但细细研究近几年各地高考工艺流程题,不难发现这些试题考查的知识都源于书本而高于书本,如果解题方法得当,还是可以获得高分。
本题难度:一般
4、选择题 向一定量的Fe、FeO和Fe2O3的混合物中加入120mL?4mol/L的稀硝酸,恰好使混合物完全溶解,放出1.344LNO(标准状况),往所得溶液中加入KSCN溶液,无红色出现.若用足量的CO在加热下还原相同质量的混合物,最终得到铁的物质的量为
A.0.24mol
B.0.21mol
C.0.25mol
D.0.12mol
参考答案:B
本题解析:n(HNO3)=0.12L×4mol/L=0.48mol,n(NO)=1.344L÷22.4L/mol=0.06mol,往所得溶液中加入KSCN溶液,无红色出现,说明全部生成Fe2+,溶液溶质为Fe(NO3)2,则原混合物中Fe为(0.48mol-0.06mol)÷2==0.21mol,则若用足量的CO在加热下还原相同质量的混合物,最终得到铁的物质的量为0.21mol,故选B。
本题难度:一般
5、选择题 2009年10月1日,在天安门广场上举行了隆重的国庆阅兵仪式,展现了我国强大的综合国力,这之中坦克的展示无疑是一个巨大的亮点.一般的坦克的材料大都用了各种金属的合金,铁便是其中十分重要的一种.那么下列关于铁的各种说法中正确的是
A.铁是26号元素,位于元素周期表第四周期,第VIIIB族
B.在酸性条件下,铁可与氢氧化铁反应
C.绿矾晶体可用于净水,是利用了其还原性
D.FeO与HNO3反应,有红棕色气体放出
参考答案:B
本题解析:分析:A.Fe位于周期表第四周期,第VIII族;
B.Fe和与Fe3+反应;
C.绿矾用于净水是利用了吸附性;
D.FeO与浓HNO3反应时,有红棕色气体放出.
解答:A.Fe位于周期表第四周期,第VIII族,故A错误;
B.在酸性条件下,氢氧化铁与酸反应生成Fe3+,Fe和与Fe3+反应生成Fe2+,故B正确;
C.绿矾晶体可用于净水,是利用Fe2+的水解后最终能制得Fe(OH)3胶体,利用了胶体的吸附性,但绿矾本身不能净水,故C错误;
D.FeO与浓HNO3反应时,有红棕色气体放出,与稀硝酸反应生成NO,无色,故D错误.
故选B.
点评:本题考查铁的有关化合物的性质和用途,题目难度中等,本题注意把握相关基础知识的积累.
本题难度:困难