1、选择题 由Fe2O3、Fe、CuO、C、Al中的几种物质组成的混合粉末,取样品进行下列实验(部分产物略去)。关于混合粉末的组成判断正确的是

A.一定含CuO和C?B.一定含Fe2O3、CuO和C
C.一定含CuO和C,一定不含Al?D.气体Z为纯净物
参考答案:A
本题解析:能与Fe、Fe2O3、CuO、C、Al物质反应产生两种气体的浓酸不可能是浓盐酸;如果是浓硫酸,可以与C、Al、Fe单质发生氧化还原反应,浓硫酸被还原为SO2,C被氧化为CO2,Al被氧化为Al3+,铁被氧化为铁离子;如果是浓硝酸,则两种气体是CO2和NO2,其变化与加浓硫酸的反应相同.无论是那种浓酸均可以使两种氧化物Fe2O3、CuO转化为对应的盐,所以X为SO2和CO2或者CO2和NO2。向溶液X中加过量Fe粉,得Y溶液和两种固体,且一种固体为红色(Cu),另一种就是过量的Fe粉,根据上述分析可知,样品中一定有CuO和C,不能确定是否有Fe2O3、铁和铝。如果两种气体是CO2和NO2,通入水中NO2被吸收生成硝酸和NO,所得气体Z还是混合物,所以正确的答案选A。
本题难度:一般
2、填空题 某矿渣的成分为Cu2O、Al2O3、Fe2O3、SiO2,工业上用该矿渣获取铜和胆矾的操作流程如下:
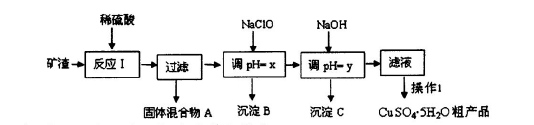
已知: ①Cu2O +2 H+="Cu" + Cu2++H2O
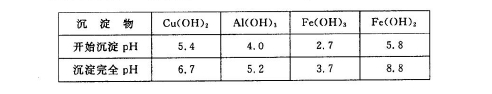
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
请回答下列问题:
(1)为了加快反应I的速率,可以采取的措施是??(写2点)。
(2)固体混合物A中的成分是?。
(3)反应I完成后,铁元素的存在形式为?(填离子符号);写出生成该离子的离子方程式??。
(4)操作1主要包括:?、?、?。洗涤CuSO4?5H2O粗产品不能用大量水洗,而用冰水洗涤。原因是??。
(5)用惰性电极电解胆矾溶液一段时间,加人0.1 mol的Cu(OH)2可恢复溶液原况(浓度、成分),则电解时转移电子的物质的量为?.。
(6)用NaClO调pH,生成沉淀B的同时生成一种具有漂白作用的物质,该反应的离子方程式为 ?。
参考答案:(1)适当升高温度;不断搅拌;将矿渣粉碎;适当增大硫酸的浓度等;
(2)SiO2、Cu?
(3)Fe3+? 2Fe3++Cu=Cu2++2Fe2+
(4)蒸发浓缩、冷却结晶、过滤;冰水既可以洗去晶体表面的杂质离子,又可以减少晶体的损失;
(5)0.4mol
(6)2Fe2++7ClO-+2H++5H2O=2Fe(OH)3+Cl-+6HClO
本题解析:(1)由于矿渣为固体,所以为了加快反应I的速率,可以采取的措施是浆固体粉碎。也可以适当升高反应的温度;或增大反应物H2SO4的浓度等措施。(2)SiO2是酸性氧化物,不能与酸发生反应;其它金属氧化物Cu2O、Al2O3、Fe2O3与硫酸发生反应:Cu2O+H2SO4=Cu+CuSO4+H2O;Al2O3+3H2SO4= Al2(SO4)3+3H2O;Fe2O3+3H2SO4= Fe2(SO4)3+3H2O; Fe2(SO4)3+Cu= CuSO4+ 2FeSO4。因此发生反应I后过滤出的固体混合物A中的成分是SiO2、Cu。(3)因为在矿渣中Fe元素的化合价为+3价,先发生复分解反应,得到Fe2(SO4)3,然后发生反应:2Fe3++Cu=Cu2++2Fe2+。因此该完成后,铁元素的存在形式为+2价的Fe。即Fe2+。(4)从硫酸铜溶液中制取硫酸铜晶体的操作1主要包括: 蒸发浓缩、冷却结晶、过滤。洗涤CuSO4?5H2O粗产品不能用大量水洗,而用冰水洗涤。原因是CuSO4溶液溶解于水,而且温度越高,溶解度越大。若用冰水既可以洗去晶体表面的杂质离子,又可以减少晶体的损失;(5)用惰性电极电解胆矾溶液电解反应方程式为:2CuSO4+2H2O 2Cu+O2↑+2H2SO4.若加入0.1 mol的Cu(OH)2会发生反应:Cu(OH)2+H2SO4= CuSO4+2H2O 。产生0.1mol的CuSO4和0.2mol的水恢复原来的溶液。则根据电解方程式中的物质间的关系可知电子转移0.4mol。(6)NaClO有氧化性,Fe2+有还原性。所以用NaClO调节pH,生成沉淀B为Fe(OH)3,同时生成一种具有漂白作用的物质为HClO,该反应的离子方程式为2Fe2++7ClO-+2H++5H2O=2Fe(OH)3↓+Cl-+6HClO
2Cu+O2↑+2H2SO4.若加入0.1 mol的Cu(OH)2会发生反应:Cu(OH)2+H2SO4= CuSO4+2H2O 。产生0.1mol的CuSO4和0.2mol的水恢复原来的溶液。则根据电解方程式中的物质间的关系可知电子转移0.4mol。(6)NaClO有氧化性,Fe2+有还原性。所以用NaClO调节pH,生成沉淀B为Fe(OH)3,同时生成一种具有漂白作用的物质为HClO,该反应的离子方程式为2Fe2++7ClO-+2H++5H2O=2Fe(OH)3↓+Cl-+6HClO
本题难度:困难
3、选择题 下列各物质不能由组成它的两种元素单质经点燃或加热直接化合而得到的是(? )
A.FeS
B.Fe3O4
C.FeCl2
D.FeCl3
参考答案:C
本题解析:铁与Cl2反应产物是FeCl3。
本题难度:简单
4、实验题 (8分)按右图所示操作,充分反应后:
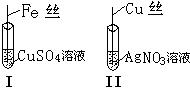
⑴ I中铁丝上观察到的现象 是?
是? ?;
?;
反应的化学方程式为??;
⑵ II中发生反应的化学方程式为 ?;
?;
⑶结合I、II实验现象可知,Fe、Cu、Ag的还原性顺序为????。
参考答案:(8分)
(1)铁丝上附着一层红色固体;Fe+CuSO4==FeSO4+Cu
(2)Cu+2AgNO3===Cu(NO3)2+2Ag
(3)Fe>Cu>Ag(每空2分)
本题解析:略
本题难度:一般
5、填空题 生锈的铁钉与过量的盐酸发生反应的离子方程式为____________。
参考答案:Fe2O3+6H+==2Fe3++3H2O? 、?Fe+2H+==Fe2++H2↑
本题解析:
本题难度:一般