1、选择题 下列说法正确的是
[? ]
A.钠保存在煤油里的原因之一是它极易与氧气反应
B.铝在空气中很容易燃烧
C.镁表面的氧化膜疏松,不能保护内层金属
D.铁锈的主要成分是Fe3O4
参考答案:A
本题解析:
本题难度:简单
2、实验题 绿矾(FeSO4?7H2O)是治疗缺铁性贫血的特效药。某学校的化学兴趣小组的同学对绿矾进行了如下的探究:
FeSO4?7H2O的制备
该化学兴趣小组的同学在实验室通过如下实验由废铁屑(含少量氧化铜、氧化铁等杂质)制备FeSO4·7H2O晶体:
①将5%Na2CO3溶液加入到盛有一定量废铁屑的烧杯中,加热数分钟,用倾析法除去
Na2CO3溶液,然后将废铁屑用水洗涤2~3遍。
②向洗涤过的废铁屑中加入过量的稀硫酸,控制温度在50~80℃之间至铁屑耗尽;
③趁热过滤,将滤液转入到密闭容器中,静置、冷却结晶;
④待结晶完毕后,滤出晶体,用少量冰水洗涤2~3次,再用滤纸将晶体吸干;
⑤将制得的FeSO4·7H2O晶体放在一个小广口瓶中,密闭保存。
请回答下列问题:
(1)实验步骤①的目的是 。
(2)实验步骤②明显不合理,理由是 。
(3)为了洗涤除去晶体表面附着的硫酸等杂质,实验步骤④中用少量冰水洗涤晶体,原因是 。
(二)探究绿矾(FeSO4·7H2O)热分解的产物
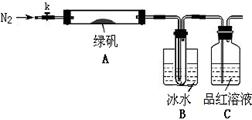
已知SO3的熔点是16.8°C,沸点是44.8°C,该小组设计如下图所示的实验装置(图中加热、夹持仪器等均省略):
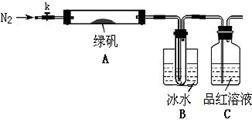
【实验过程】
①仪器连接后,检查装置A与B气密性;
②取一定量绿矾固体置于A中,通入N2以驱尽装置内的空气,关闭k,用酒精灯加热硬质玻璃管;
③观察到A 中固体逐渐变红棕色,B中试管收集到无色液体,C中溶液褪色;
④待A中反应完全并冷却至室温后,取少量反应后固体于试管中,加入硫酸溶解,取少量滴入几滴KSCN溶液,溶液变红色;
⑤往B装置的试管中滴入几滴BaCl2溶液,溶液变浑浊。
(4)实验结果分析
结论1:B中收集到的液体是?;
结论2:C中溶液褪色,可推知产物中有?;
结论3:综合分析上述实验③和④可推知固体产物一定有Fe2O3。
【实验反思】
(5)请指出该小组设计的实验装置的明显不足:?。
(6)分解后的固体中可能含有少量FeO,取上述实验④中盐酸溶解后的溶液少许于试管中,选用一种试剂鉴别,该试剂最合适的是?。
a.氯水和KSCN溶液? b.酸性KMnO4溶液? c.H2O2? d.NaOH溶液
参考答案:(1)除油污;
(2)应该铁屑过量(或反应后溶液中必须有铁剩余),否则溶液中可能有Fe3+存在;
(3)用冰水洗涤可降低洗涤过程中FeSO4·7H2O的损耗;
(4)H2SO4溶液、SO2;
(5)在C装置后增加一套尾气处理装置;?
(6)b。
本题解析:(1)碳酸钠溶液与废铁屑的成分均不能反应,故只起去油污的作用;(2)结合废铁屑的成分和后边的步骤可知,必须保证铁有剩余,才能保证溶液中没有铁离子;(3)降低温度,减小绿矾的溶解度;(4)硫酸亚铁晶体受热有水蒸汽生成,根据三氧化硫的熔点可知,冰水能将三氧化硫和水液化,在B中反应生成硫酸;C中是生成的二氧化硫使品红溶液褪色 ;(5)二氧化硫要进行尾气处理;(6)固体中有氧化铁,溶于盐酸后有三价铁生成,要想检验二价铁的存在,需利用亚铁离子的还原性,使酸性高锰酸钾溶液褪色,故选b。
本题难度:困难
3、选择题 含有1mol HNO3的稀硝酸分别与不同质量的铁粉反应,所得氧化产物a、b与铁粉物质的量关系如图所示。下列有关判断正确的是?(?)
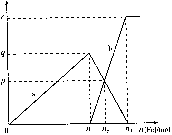
A.a是Fe(NO3)2
B.n1=0.375
C.P=0.125
D.n2=0.30
参考答案:D
本题解析:略
本题难度:一般
4、选择题 下列关于铁元素的叙述中正确的是( )
A.2Fe3++Cu===2Fe2++Cu2+成立说明氧化性:Fe3+> Cu 2+
B.25℃,pH=0的溶液中,Al3+、NH4+、NO3—、Fe2+可以大量共存
C.5.6 g铁与足量的氯气反应失去电子为0.2 mol
D.硫酸铁溶液中加入铁粉,滴加KSCN溶液一定不变红色
参考答案:A
本题解析:A、反应中Fe3+做氧化剂 Cu 2+是氧化产物。根据氧化还原反应的氧化性判断规律,氧化性:氧化剂>氧化产物,所以A正确。故选A。
B、pH=0的溶液中,溶液含有较大浓度的H+,NO具有强氧化性与还原性的Fe2+不能大量共存。
C、5.6gFe为0.1mol与氯气反应时被氧化成Fe3+失去电子为0.3mol。故C错误。
D、硫酸铁溶液中加入铁粉,Fe3+不一定反应完全,滴加KSCN溶液有可能变红色。D错误。
点评:掌握铁及其化合物的相关性质是解题的关键。
本题难度:一般
5、选择题 向一定量Fe、FeO和Fe2O3的混合物中加入120 mL 4mol·L-1的稀硝酸恰好使混合物完全溶解,放出1.344L NO(标准状况),往所得溶液中加入KSCN溶液,无红色出现。?若用足量的H2在加热条件下还原相同质量的混合物,能得到铁的物质的量为
A.0.14mol
B.0.16mol
C.0.21mol
D.0.24m
参考答案:A
本题解析:往所得溶液中加入KSCN溶液,无红色出现,则溶液中无Fe2+,根据溶液中N元素质量守恒n(HNO3)="n(NO)+" n(NO3-),知n(NO3-)=0.42mol。所以溶液中n(Fe2+) =0.21mol,有铁元素的质量守恒能得到铁的物质的量为0.21mol。C正确。
本题难度:简单