1、选择题 实验中需0.5 mol/L的NaOH溶液230 mL,配制时应选用容量瓶的规格和称取NaOH的质量分别是
[? ]
A.240 mL,4.8 g
B.250 mL,5.0 g
C.500 mL,10.0 g
D.任意规格,4.8 g
参考答案:B
本题解析:
本题难度:简单
2、选择题 标准状况下,1L水能溶解VL氨气,若所得溶液的密度为dg/cm3,则所得氨水的物质的量浓度为(溶质以NH3为标准)
A.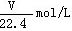
B.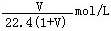
C.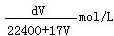
D.
参考答案:D
本题解析:标准状况下VL氨气的物质的量是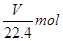 ,质量是
,质量是 。溶剂水的质量是1000g,所以溶质的质量分数是
。溶剂水的质量是1000g,所以溶质的质量分数是 ,则根据
,则根据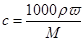 可知,溶液的物质的量浓度是
可知,溶液的物质的量浓度是 ,答案选D。
,答案选D。
点评:该题是中等难度的试题,试题综合性强,计算量比较大。在理解物质的量浓度概念的基础上,还需要认真,细致,有助于培养学生的规范答题能力和应试能力,提高学生的学习效率,增强学生的学习自信心。
本题难度:简单
3、计算题 1mol锌与足量的稀硫酸反应,求反应后生成的标准状况下的气体的体积为多少升?
参考答案:22.4L
本题解析:由Zn+H2SO4=ZnSO4+H2↑知可生成1 mol气体,在标状下体积为22.4L
本题难度:一般
4、简答题 实验室需要250mL1mol?L-1的Na2CO3溶液,现有以下仪器:
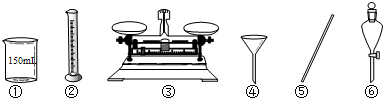
(1)用Na2CO3固体配制溶液时,上述仪器中必须使用到的有______(填序号).
(2)若要实施配制,除上述仪器外,尚缺的仪器或用品有______、______等(填仪器名称).
(3)配制溶液时,一般可以分为以下几个操作步骤:
A.转移B.称量C.洗涤D.定容E.溶解F.摇匀G.冷却
其正确的操作顺序应是BE______DF(补填序号).
(4)配制过程中,若其他操作都正确,下列操作会引起浓度偏大的是______.
A.定容摇匀后发现液面低于刻度线B.定容时俯视容量瓶的刻度线
C.将溶液转入容量瓶后,没有洗涤烧杯和玻璃棒,就转入定容操作
D.如果加水超过了刻度线,取出少量水使液面恰好到刻度线
(5)由计算可知,在称量操作中,需用托盘天平称量Na2CO3固体的质量为______,若用5mol?L-1Na2CO3溶液配制该溶液,则应用量筒量取该溶液的体积为______.
参考答案:(1)操作步骤有计算、称量、溶解、移液、洗涤移液、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解(可用量筒量取水加入烧杯),并用玻璃棒搅拌,加速溶解,冷却后转移到250mL容量瓶中,并用玻璃棒引流,洗涤烧杯、玻璃棒2-3次,并将洗涤液移入容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀,所用仪器有托盘天平、烧杯、玻璃棒、250mL容量瓶、胶头滴管、药匙,根据提供仪器,上述仪器中必须使用到的有①③⑤,
故答案为:①③⑤;
(2)实验 所用仪器有托盘天平、烧杯、玻璃棒、250mL容量瓶、胶头滴管、药匙,除上述仪器外,尚缺的仪器或用品有250mL容量瓶 胶头滴管,
故答案为:250mL容量瓶;胶头滴管;
(3)操作步骤有:计算、称量、溶解、冷却、移液、洗涤移液、定容、摇匀等操作,其正确的操作顺序应是BEGACADF,
故答案为:GACA;
(4)A.定容摇匀后发现液面低于刻度线,属于正常现象,溶液的物质的量浓度不变,故A错误;
B.定容时俯视容量瓶的刻度线,溶液的体积偏小,根据c=nV可知溶液的物质的量浓度偏大,故B正确;
C.将溶液转入容量瓶后,没有洗涤烧杯和玻璃棒,溶质的物质的量偏小,根据c=nV可知溶液的物质的量浓度偏小,故C错误;
D.如果加水超过了刻度线,取出少量水使液面恰好到刻度线,溶质的物质的量偏小,根据c=nV可知溶液的物质的量浓度偏小,故D错误;
故选:B;
(5)需要碳酸钠的质量m=0.25L×1mol?L-1×106g/mol=26.5g;
设5mol/L的碳酸钠溶液的体积为xmL,则xmL×5mol/L=250mL×1mol/L,解得:x=50.0,
所以应量取5mol/L的碳酸钠溶液的体积是50.0mL,
故答案为:26.5g;50.0mL.
本题解析:
本题难度:一般
5、选择题 NA表示阿伏加德罗常数的值,下列说法正确的是( )
①用铜作电极电解饱和NaCl溶液,当线路中通过NA个电子时,阳极产生11.2 L气体(标准状况下) ②常温常压下,16 g O2和16 g O3含氧原子数均为NA ③标准状况下,22.4 L CH3CH2OH中含有的碳原子数为2NA ④6.5 g锌全部溶于一定量的浓硫酸,生成SO2与H2的混合气体,气体分子总数为0.1NA ⑤10.6 g Na2CO3粉末中含有CO32-数为0.1NA
A.②④⑤
B.①③⑤
C.①②④⑤
D.①②③
参考答案:A
本题解析:①用铜作电极电解饱和氯化钠溶液,阳极是铜失电子转化成Cu2+,阳极得不到氯气,错误;②16 g O2的物质的量为0.5 mol,含氧原子数为NA,16 g O3的物质的量为1/3 mol,含氧原子数为NA,正确;③在标准状况下,乙醇为液体,不能运用标准状况下的气体摩尔体积计算,错误;④6.5 g锌的物质的量为0.1 mol,完全反应失去电子0.2 mol,由H2SO4~SO2、H2SO4~H2可知,生成1 mol SO2或1 mol H2都需要转移2 mol e-,所以气体分子总数为0.1NA,正确;⑤Na2CO3是离子化合物,固体中含有钠离子和碳酸根离子,10.6 g Na2CO3的物质的量为0.1 mol,含碳酸根离子数为0.1NA,正确。综上所述,A正确。
本题难度:一般