1、选择题 下列说法正确的是(? )
A.25℃时,向饱和AgCl水溶液中加入盐酸,Ksp值变大
B.25℃时,向CaCO3饱和溶液通入CO2,有沉淀生成
C.25℃时,AgCl水溶液中,c(Ag+)和c(Cl-)的乘积是一个常数
D.25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大
参考答案:D
本题解析: Ksp 只与温度有关,温度不变Ksp 值不变,所以A错误;B项中的碳酸钙溶液已经达饱和状态,通入二氧化碳,没有沉淀生成,B错误;C项中的氯化银水溶液不一定是饱和的,所以c(Ag+)和c(Cl-)的 乘积不一定是一个常数,C错误;在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,NH4+与OH-结合生成了可溶的一水合氨,使得Mg(OH)2的溶解平衡向右移动,使c(Mg2+)增大,D正确,故选D。
本题难度:一般
2、选择题 在BaSO4饱和溶液中加入少量BaCl2溶液时产生沉淀,若以Ksp表示BaSO4的溶度积常数,则平衡后溶液中( )
A.c(Ba2+)=c(SO )=(Ksp)
)=(Ksp)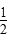
B.c(Ba2+)·c(SO )=Ksp,c(Ba2+)>c(SO
)=Ksp,c(Ba2+)>c(SO )
)
C.c(Ba2+)·c(SO )>Ksp,c(Ba2+)=c(SO
)>Ksp,c(Ba2+)=c(SO )
)
D.c(Ba2+)·c(SO )≠Ksp,c(Ba2+)<c(SO
)≠Ksp,c(Ba2+)<c(SO )
)
参考答案:B
本题解析:BaSO4 Ba2++SO
Ba2++SO ,当加入BaCl2时,溶液中的c(Ba2+)增大,平衡向左移动,但溶度积常数不变,而且c(Ba2+)>c(SO
,当加入BaCl2时,溶液中的c(Ba2+)增大,平衡向左移动,但溶度积常数不变,而且c(Ba2+)>c(SO )。
)。
本题难度:一般
3、选择题 下列有关实验的叙述正确的是
A.已知Cu2O+2H+=Cu2++Cu+H2O,氢气还原氧化铜后生成的红色固体能完全溶于稀硝酸,说明还原产物是铜
B.在中和热测定的实验中,将NaOH溶液和盐酸混合反应后的冷却温度作为末温度
C.仅用淀粉溶液、稀硫酸、碘水、新制氢氧化铜四种试剂可完成淀粉水解产物及水解程度检验的探究实验
D.向盛有少量Mg(OH )2悬浊液的试管中滴加氯化铵溶液,可以看到沉淀溶解
参考答案:D
本题解析:Cu2O也是红色固体,若用稀硝酸溶解金属,由于Cu2O在酸性条件下会发生歧化反应产生Cu单质和Cu2+,Cu能与有强氧化性的硝酸反应。因此红色固体能完全溶于稀硝酸,不能说明还原产物是铜。错误。B.在中和热测定的实验中,将NaOH溶液和盐酸混合反应后的最高温度作为末温度。错误。C.向淀粉溶液中加入稀硫酸并加热,然后用NaOH中和催化剂硫酸。取少量反应后的溶液,向其中滴加碘水,若未变为蓝色,证明淀粉水解完全,再另去少量溶液,加入新制氢氧化铜悬浊液,加热煮沸,若产生砖红色沉淀,就证明水解产物是葡萄糖,否则就证明没有葡萄糖。因此仅用这四种试剂不可完成淀粉水解产物及水解程度检验的探究实验。错误。D.Mg(OH )2在水溶液中存在沉淀溶解平衡,向盛有少量Mg(OH )2悬浊液的试管中滴加氯化铵溶液,会发生反应:NH4++OH-= NH3·H2O,破坏了沉淀溶解平衡,是沉淀继续溶解,直至达到新的平衡状态。因此可以看到沉淀溶解。正确。2O的性质的知识。
本题难度:一般
4、选择题 下列说法中,正确的是
A.难溶电解质在水溶液中达到沉淀溶解平衡时,沉淀和溶解即停止
B.Ksp越小,难溶电解质在水中的溶解能力一定越弱
C.Ksp的大小与离子浓度无关,只与难溶电解质的性质和温度有关
D.相同温度下, AgCl在水中的溶解能力与在NaCl溶液中的相同
参考答案:C
本题解析:
正确答案:C
A.不正确,难溶电解质在水溶液中达到沉淀溶解平衡时,沉淀和溶解仍在进行,只是沉淀速率等于溶解速率;
B.不正确,当物质的组成相似时,Ksp越小,难溶电解质在水中的溶解能力一定越弱;
C.正确;
D.不正确,相同温度下, AgCl在水中的溶解能力比在NaCl溶液中大,NaCl溶液中Cl―浓度大,抑制AgCl溶解。
本题难度:简单
5、选择题 取一定量的PbI2固体用蒸馏水配成饱和溶液,量取25.00mLPbI2饱和溶液,分次慢慢加入交换柱,进行如下离子交换反应:Pb2+(aq)+2R-H(s)=R2Pb(s)+2H+(aq),用洁净的锥形瓶接流出液,待溶液流出后,再用蒸馏水淋洗树脂至流出液呈中性,将洗涤液一并放在锥形瓶中,加入指示剂,用0.0025mol/LNaOH溶液滴定,当达到滴定终点时,用去氢氧化钠溶液20.00mL.结合上述实验数据(已知lg2=0.3),下列有关说法正确的是( )
A.常温下,0.0025mol/LNaOH溶液?pH=11.4
B.在温度不变时,向PbI2饱和溶液中加入少量硝酸铅浓溶液,PbI2的Ksp减小
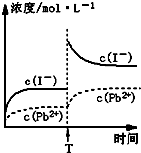
C.温度不变,T时刻,向PbI2饱和溶液中加入少量KI浓溶液,离子浓度变化如图所示
D.本次实验测得的t℃PbI2的Ksp=4×10-9
参考答案:A、常温下,0.0025mol/LNaOH溶液中c(OH-)=0.0025mol/L;c(H+)=10-140.0025=4×10-12mol/L; pH=-lg4×10-12mol/L=11.4,故A正确;
B、在温度不变时,向PbI2饱和溶液中加入少量硝酸铅浓溶液,PbI2的Ksp不变,故B错误;
C、依据PbI2(s)?Pb2++2I-;温度不变,T时刻,向PbI2饱和溶液中加入少量KI浓溶液,平衡左移,平衡后溶液中碘离子浓度增大,铅离子浓度减小,故图象不正确,故C错误;
D、,用0.0025mol/LNaOH溶液滴定,当达到滴定终点时,用去氢氧化钠溶液20.00mL,测得氢离子物质的量为5×10-5mol,依据Pb2+(aq)+2R-H(s)=R2Pb(s)+2H+(aq),计算得到Pb2+物质的量=2.5×10-5mol;n(I-)=5×10-5mol;Ksp=c(Pb2+)×c2(I-)2.5×10-5mol0.025L×(5×10-5mol0.025L)2=4×10-9 ,故D正确;
故选AD.
本题解析:
本题难度:一般