1、选择题 室温时,将浓度和体积分别为c1、v1的NaOH溶液和c2、v2的CH3COOH溶液相混合,下列关于该混合溶液的叙述正确的是
A.若pH>7时,则一定是c1v1=c2v2
B.在任何情况下都是c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
C.当pH=7时,可能有c1/c2 > v2/v1
D.若V1=V2,c1=c2,则c(CH3COO-)+C(CH3COOH)=C(Na+)
参考答案:BD
本题解析:
A:错。NaOH + CH3COOH = CH3COONa + H2O 根据反应方程式可知当两者物质的量相等时刚好反应完全,生成CH3COONa水解显碱性。但是题设条件中可能c1v1>c2v2 即NaOH有剩余溶液呈碱性。
B:根据电解质溶液中电中性原则可知:阳离子有:H+? Na+?阴离子有:OH- CH3COO-
C:c1/c2 > v2/v1 式子作变形后可得:c1v1=c2v2刚好中和溶液呈碱性:pH>7
D:由V1=V2,c1=c2 ?可得c1v1=c2v2刚好中和。物料守恒。
本题难度:简单
2、填空题 已知:Ksp(AgCl)=c(Ag+)·c(Cl-)=1.8×10-10,
Ksp(Ag2CrO4)=c2(Ag+)·c(CrO42-)=1.6×10-12,现用0.01 mol/L AgNO3溶液滴定0.01 mol/L KCl和0.001 mol/L K2CrO4混合溶液,通过计算回答:
(1)Cl-、CrO42-先生成沉淀的是________。
(2)当刚出现Ag2CrO4沉淀时,溶液中Cl-浓度是________mol/L。(设混合溶液在反应中体积不变)
参考答案:(1)Cl-先沉淀(2分) (2)4.5×10-6mol/L(3分)
本题解析:略
本题难度:一般
3、选择题 在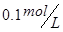
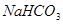 溶液中,下列关系中不正确的是
溶液中,下列关系中不正确的是
A.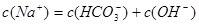
B.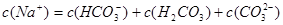
C.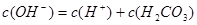 -c(CO32-)
-c(CO32-)
D.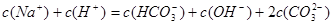
参考答案:A
本题解析:略
本题难度:简单
4、选择题 下列盐既能发生水解反应,蒸干该盐溶液并充分加热后又能得到该盐(加热体系)的是
A.Na2CO3
B.AlCl3
C.NaCl
D.NH4Cl
参考答案:A
本题解析:A、正确;B、加热时水解产生的HCl挥发,平衡正向移动得到氢氧化铝,错误;C、不水解,错误;D、受热易分解,错误。
本题难度:一般
5、选择题 实验中需2mol/L的Na2CO3溶液950mL,配制时应选用的容量瓶的规格和称取Na2CO3质量是
A.1000mL,212g
B.950mL,543.4g
C.950mL,572g
D.500mL,286g
参考答案:A
本题解析:由于容量瓶的规格中不可能有950mL,只能选择略大于所需溶液体积的规格(即1000mL),计算溶质的质量时也就按1000mL溶液中所含的溶质。Na2CO3 物质的量为 2*1="=2" mol/L,则质量为物质的量*摩尔质量="=2*106==212" g。故本题选A。
本题难度:一般