1、填空题 (6分)某状况下,2g二氧化碳气体的体积是 1120 mL,2g A 气体的体积是 770 mL,A的摩尔质量是__________。 某金属氯化物 MCl2 40.5 g含 0.6 mol Cl-,则该氯化物的摩尔质量为__________,金属M的相对原子质量为__________。
参考答案:A的摩尔质量是__64g/mol________。
该氯化物的摩尔质量为_135g/mol_________,
金属M的相对原子质量为__64________。
本题解析:略
本题难度:简单
2、填空题 实验室用氯化钠固体配制1.00 mol/L的NaCl溶液0.5 L,回答下列问题:
(1)请写出该实验的实验步骤:
① ,② ,③ ,④ ,⑤ ,⑥ 。
(2)所需仪器为:托盘天平、还需要那些实验仪器才能完成该实验,请写出: 。
(3)试分析下列操作对所配溶液的浓度有何影响及造成该影响的原因。
定容后,加盖倒转摇匀后,发现液面低于刻度线,又滴加蒸馏水至刻度。对所配溶液浓度的影响: ,原因是: 。
参考答案:(1)①计算 ②称量 ③溶解 ④移液 ⑤洗涤 ⑥定容
(2)500 mL容量瓶 烧杯、玻璃棒、胶头滴管
(3)偏小 溶液体积增大,溶质物质的量不变
本题解析:(1) 溶液配制步骤要记清楚;(2)配制溶液时需要的仪器要和步骤联系。如溶解用到烧杯和玻璃棒,转移溶液用到玻璃棒,定容用到胶头滴管。
(3)定容后,加盖倒转摇匀后,液面低于刻度线,是正常的,若加蒸馏水至刻度线,则溶液体积增大,而溶质的物质的量不变。所配溶液的浓度偏小。
考点:一定物质的量浓度的溶液的配制。
本题难度:一般
3、选择题 在标准状况下,将a L NH3完全溶于水得到VmL氨水,溶液的密度为ρ g/cm3,溶质的质量分数为w,溶质的物质的量浓度为c mol/L。下列叙述中正确的是
[? ]
A.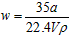
B.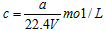
C.上述氨水中再加入等体积等浓度的稀盐酸后溶液恰好呈中性
D.上述氨水中再加入V mL水后,所得溶液的质量分数小于0.5w
参考答案:D
本题解析:
本题难度:一般
4、计算题 (6分)计算题:
(1)实验室用0.2L 0.5mol/L氢氧化钠溶液来吸收氯气尾气,并利用以下所给的方程式计算: 标准状况下,最多能吸收到多少升氯气?2NaOH+Cl2===NaCl+NaClO+H2O
(2)实验室配制0.5 mol·L-1硫酸溶液500 mL,需要质量分数为98%、密度为1.84 g·cm-3的浓硫酸的体积为 mL。
参考答案:(1)1.12L (2)13.6
本题解析:(1)NaOH的物质的量为:n(NaOH)=cV=0.5mol/L×0.2L=0.1mol,设可吸收的氯气物质的量为x.则有:
2NaOH+Cl2===NaCl+NaClO+H2O
2 1
0.1mol x 得:x=0.05mol,V=n×22.4L/mol=0.05mol×22.4L/mol=1.12L
(2)质量分数为98%、密度为1.84 g·cm-3的浓硫酸的浓度为:c=1000×1.84 g·cm-3×98%÷98g/mol=18.4mol/L,根据溶液稀释的公式: c浓×V浓=c稀×V稀,18.4mol/L×V浓=0.5 mol·L-1×500 mL,V浓=13.6mL
考点:物质的量在化学反应中的应用、溶液稀释的计算。
本题难度:一般
5、填空题 (11分)一定质量的镁、铝混合物投到2 mol·L-1的盐酸中,待金属完全溶解后,向溶液中加入2 mol·L-1的氢氧化钠溶液,生成沉淀的质量与加入氢氧化钠溶液的体积关系如图所示。则:
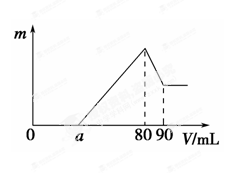
(1)80~90ml对应反应的离子方程式 。
(2)金属铝的质量为______ _
(3)盐酸的体积是 ml。
(4)a的取值范围是___ __。
(5)n(Mg)/n(Al)的最大值是 。
参考答案:(1)Al(OH)3+ OH-=AlO2-+2H2O (2)0.54g
(3)80 (4)0≤a<50 (5)2.5
本题解析:
(1)根据图可知,首先发生的反应是中和过量的酸:H++OH-=H2O,然后是沉淀两种金属离子:Mg2++2OH-=Mg(OH)2↓、Al3++3OH-=Al(OH)3↓,最后是Al(OH)3的溶解:Al(OH)3+ OH-=AlO2-+2H2O,即80~90ml对应反应的离子方程式为Al(OH)3+ OH-=AlO2-+2H2O;
(2)从横坐标80mL到90mL这段可以求出n(Al(OH)3)=n(OH-)=2 mol·L-1×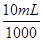 =0.02mol,则n(Al)=n(Al(OH)3)=0.02mol,即为0.54g;
=0.02mol,则n(Al)=n(Al(OH)3)=0.02mol,即为0.54g;
(3)镁、铝混合物投到盐酸中,生成氯化镁和氯化铝,并且从图上可知盐酸过量,当加入氢氧化钠溶液后,氢氧化钠先与过量的酸反应生成氯化钠,后氢氧化钠又与氯化镁和氯化铝反应生成氯化钠,当氢氧化钠溶液的体积为80mL时,盐酸中的氯离子都与钠离子结合成氯化钠,根据原子守恒可知,n(HCl)=n(NaOH)=2 mol·L-1×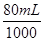 ,则盐酸的体积为V=
,则盐酸的体积为V=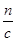 =80mL;
=80mL;
(4)假设盐酸溶解金属后不剩,这种情况下,酸恰好与合金反应完全,即a=0,通过极值法,当合金中完全是铝时,因为沉淀Al3+需要NaOH溶液的体积为30mL,从图可知,中和过量的酸所消耗的碱液体积最大为50mL,但是假设不成立,最大值是不存在的,所以的取值范围为 0≤a<50;
(5)n(Al)=n(Al(OH)3)=2mol?L-1×0.01L=0.02mol,所以沉淀Al3+需要的OH-为0.06mol,即NaOH溶液的体积为30mL,镁离子和铝离子沉淀完全消耗的碱的体积为80-a,若假设盐酸不剩,所以沉淀Mg2+需要NaOH溶液的体积最大值为50mL,求出n(Mg)的最大值为0.05mol,所以该合金中镁铝两元素物质的量之比的最大值为0.05mol:0.02mol=2.5。
考点:考查镁、铝的化学性质及计算
点评:本题考查了镁、铝的化学性质及计算,难度中等。解题时要注意根据镁铝的化学性质结合图像中的数量关系解答。(4)(5)两问可以采用假设法求极值。
本题难度:一般