|
高考化学试题《物质的量》高频试题巩固(2017年最新版)(六)
2018-03-17 06:58:55
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
1、实验题 欲配制480mL 0.2mol/L的NaCl溶液,回答下列问题:
(1)应用托盘天平准确称取固体NaCl g。
(2)以下是实验操作步骤,正确的操作顺序是:
①称取所需质量的NaCl
②将溶液转移到容量瓶内
③用蒸馏水洗涤烧杯2~3次,将洗涤液全部移入容量瓶中,摇匀
④改用胶头滴管,小心滴入蒸馏水至刻度
⑤仔细地把蒸馏水注入容量瓶中,直到液面接近刻度线1cm~2cm处
⑥塞上瓶塞,反复上下颠倒,摇匀
⑦将称取的NaCl固体,加适量蒸馏水,搅拌溶解后冷却
(3)若实验遇到下列情况,所配制的溶液浓度偏小的操作是
A.烧杯中NaCl溶液移入容量瓶后没有洗涤烧杯
B.定容后摇匀,发现液面低于刻度线,再滴加蒸馏水至刻度线
C.实验用的容量瓶洗净后未干燥,里面含有少量水
D.定容时俯视
|
参考答案:(7分)
(1)5.9 (2分)(2) ①⑦②③⑤④⑥(3分) (3)AB(2分)
本题解析:(1)欲配制480mL 0.2mol/L的NaCl溶液,则应配制500mL0.2mol/L的NaCl溶液,所以氯化钠的质量是0.5L×0.2mol/L×58.5g/mol=5.85g,根据托盘天平的精确度,所以只能称取5.9g的NaCl;
(2)用固体配制溶液的步骤是:称取氯化钠的质量、在烧杯中溶解、冷却后移入容量瓶、洗涤烧杯、玻璃棒2-3次并将洗涤液移入容量瓶、摇匀,使溶液均匀、直接把蒸馏水注入容量瓶中,至液面接近刻度线1cm~2cm处,改用胶头滴管加水,定容、盖上瓶塞上下颠倒,反复摇匀、装瓶。所以正确 操作顺序是①⑦②③⑤④⑥;
(3)A、未洗涤烧杯,造成氯化钠质量减少,所配溶液的浓度偏小,正确;B、定容后又加水,则溶液的体积偏大,溶液浓度偏小,正确;C、在配制的过程中,需直接加入蒸馏水,所以容量瓶内有少量蒸馏水,对结果无影响,错误;D、定容时俯视刻度线,使所配溶液的体积偏小,浓度偏大,错误,答案选AB。
考点:考查溶液的配制步骤的判断,误差的分析
本题难度:一般
2、选择题 最近,兰州近代物理研究所研制出我国首批氧-18气体。氧-18是氧的一种同位素,称为重氧,下列说法正确的是
[? ]
A.1.8g氧-18气体的物质的量是0.1mol
B.0.1mol重氧气体的体积是2.24L
C.重氧气体的摩尔质量为36g
D.0.1mol重氧水所含中子数约是6.02×1023个
参考答案:D
本题解析:
本题难度:简单
3、实验题 (12分)右图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。

现用该浓硫酸配制100 mL 1 mol/L的稀硫酸。可供选用的仪器有:
①胶头滴管;②烧瓶;③烧杯;④?药匙;⑤量筒;⑥托盘天平。
请回答下列问题:
(1)配制稀硫酸时,上述仪器中不需要使用的有?(选填序号),还缺少的仪器有
? ?(写仪器名称);
(2)经计算,该硫酸的物质的量浓度为?mol/L。配制100mL1mol/L的稀硫酸需要用量筒量取上述浓硫酸的体积为? ?mL(保留一位小数),量取浓硫酸时应选用?(选填①10mL、②50mL 、③100mL)规格的量筒;
(3)用胶头滴管往容量瓶中加水时,不小心液面超过了刻度,处理的方法是________(填序号)。
A.吸出多余液体,使凹液面与刻度线相切
B.小心加热容量瓶,经蒸发后,使凹液面与刻度线相切
C.经计算加入一定量的浓盐酸
D.重新配制
参考答案:(每空2分)(1)?②④⑥?; 100mL容量瓶?玻璃棒
(2)? 18.4 mol/L? 5.4?①?(3)D
本题解析:(1)由于硫酸是溶液,因此②④⑥是不需要的。根据配制原理可知,还缺少100mL容量瓶、玻璃棒。
(2)根据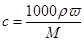 可知。硫酸的浓度是 可知。硫酸的浓度是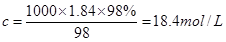 。因为稀释过程中,溶质是不变的,所以需要硫酸的体积是 。因为稀释过程中,溶质是不变的,所以需要硫酸的体积是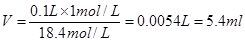 。根据规格相近的原则可知,应该选择①。 。根据规格相近的原则可知,应该选择①。
(3)用胶头滴管往容量瓶中加水时,不小心液面超过了刻度,这说明实验已知失败,只能重做,答案选D。
本题难度:一般
4、简答题 实验室配制浓度为0.2mol/L的A、B两种溶液各500ml,其中A为氢氧化钠溶液,B为硫酸溶液,提供的药品是NaOH固体,98%的浓硫酸(密度1.84g/cm3)和蒸馏水,请回答:应取NaOH______g,取浓硫酸______ml.
参考答案:A为氢氧化钠溶液,配制浓度为0.2mol/L的A溶液500ml,
则n(NaOH)=0.2mol/L×0.5L=0.1mol,
m(NaOH)=0.1mol×40g/mol=4g;
B为硫酸溶液,实验室配制浓度为0.2mol/L的B两种溶液500ml,
设取浓硫酸为x,
根据配制溶液前后溶质的物质的量不变,则
0.2mol/L×0.5L=1000×1.84×98%98×x,
解得x=5.4×10-3L=5.4mL,
故答案为:4;5.4.
本题解析:
本题难度:一般
5、选择题 已知有反应2NO+O2=2NO2。今在体积为VL的密闭容器中通入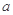 molNO和 molNO和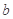 molO2。反应后容器中的氮原子和氧原子的原子个数之比是(? ) molO2。反应后容器中的氮原子和氧原子的原子个数之比是(? )
A.a/b
B.a/2b
C.a/(a+2b)
D.a/(2a+2b)
参考答案:C
本题解析:根据原子守恒可知,容器中的氮原子和氧原子的原子个数之比是a/(a+2b),答案选C。
本题难度:一般
|