1、选择题 下列图象分别表示有关反应的反应过程与能量变化的关系:
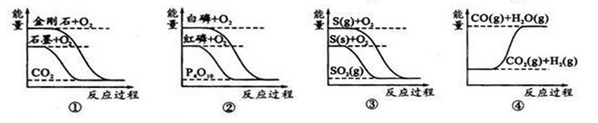
据此判断下列说法正确的是
A.石墨转变为金刚石是吸热反应
B.白磷比红磷稳定
C.CO(g)+H2O(g)=CO2(g)+H2(g)ΔH>0
D.S(g)+O2(g)=SO2(g) ΔH1; S(s)+O2(g)=SO2(g) ΔH2,则ΔH1>ΔH2
参考答案:A
本题解析:A、石墨的能量比金刚石的低,要想转变为金刚石,必须从外界吸收能量,正确;B、从图中可以看出,红磷的能量比白磷的低,能量越低,越稳定,错误;C、一氧化碳与水反应生成二氧化碳和氢气的反应是一个放热的反应,ΔH<0,错误;D、∣ΔH1∣>∣ΔH2∣,但是ΔH1<ΔH2?错误。
本题难度:一般
2、填空题 (9分)有些盐的结晶水合物,白天在温度不太高时就能熔化(实质是溶于自身的结晶水中),同时吸收热量;在晚上又可缓慢凝固而释放热量,用以调节室温,称为潜热材料。现有几种盐的水合晶体有关数据如下:
?
| Na2S2O3·5H2O
| CaCl2·6H2O
| Na2SO4·10H2O
| Na2HPO4·12H2O
|
熔点(℃)
| 40.50
| 29.92
| 32.38
| 35.1
|
熔化热(kJ/mol)
| 49.7
| 37.3
| 77
| 100.1
|
⑴上述四种水合晶体盐中最适宜用做潜热材料的两种盐是(用化学式表示)
??;?。
(2)实际应用时最常采用的(由来源和成本考虑)应该是?。
参考答案:(1)Na2SO4?10H2O?、Na2HPO4·12H2O?(2)Na2SO4?10H2O
本题解析:CaCl2?6H2O的熔点较底,不易凝固放热,所以不宜使用;Na2S2O3?5H2O的熔点较高,不易吸热熔化,所以不宜使用;而Na2SO4?10H2O 和Na2HPO4?12H2O熔点较合适,适宜使用。Na2SO4?10H2O(芒硝)储量大,价格低,比较经济,所以实际采用的是Na2SO4?10H2O。
本题难度:一般
3、选择题 化学反应中通常伴随着能量变化,下列说法中错误的是
A.煤燃烧时将部分化学能转化为热能
B.电解熔融Al2O3时将部分化学能转化为电能
C.TNT爆炸时将部分化学能转化为动能
D.镁条燃烧时将部分化学能转化为光能
参考答案:B
本题解析:电解熔融Al2O3时将部分电能转化为化学能。
本题难度:一般
4、选择题 下列说法或表示法正确的是
A.氢气与氧气反应生成等量的水蒸气和液态水,前者放出热量多
B.需要加热的反应说明它是吸热反应
C.在稀溶液中:H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ/mol,若将含0.5 mol H2SO4 的浓硫酸与含1 mol NaOH的溶液混合,放出的热量大于57.3 kJ
D.1 mol S完全燃烧放热297.3 kJ,其热化学方程式:S+O2===SO2 ΔH=-297.3 kJ/mol
参考答案:C
本题解析:气态水的能量高于液态水的能量,所以氢气与氧气反应生成等量的水蒸气和液态水,前者放出热量少,A不正确;反应条件与反应是放热反应或吸热反应无关系,B不正确;浓硫酸溶于水放出大量的热,C正确;D不正确,没有注明物质的状态,答案选C。
本题难度:一般
5、填空题 (10分)化学在生活中有很多的应用,如臭氧可用于空气净化、饮用水消毒、工业废物处理和作为漂白剂等,氮化硅(Si3N4)是一种新型陶瓷材料,具有较高的硬度且耐高温。
(1)臭氧几乎可与除铂、金、铱、氟以外的所有单质反应。已知: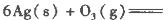
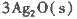 反应生成3 mol Ag2O(s)时放出的热量为
反应生成3 mol Ag2O(s)时放出的热量为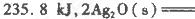
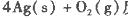 反应生成4 mol Ag(s)时吸收的热量为62.2 kJ,试根据题给数据判断O3转化为O2是________(填“放热”或“吸热”)反应。
反应生成4 mol Ag(s)时吸收的热量为62.2 kJ,试根据题给数据判断O3转化为O2是________(填“放热”或“吸热”)反应。
(2)氮化硅()可由石英与焦炭在高温的氯气流中通过如下反应制得:
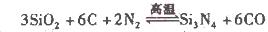
在VL的密闭容器中进行反应,实验数据如下表:
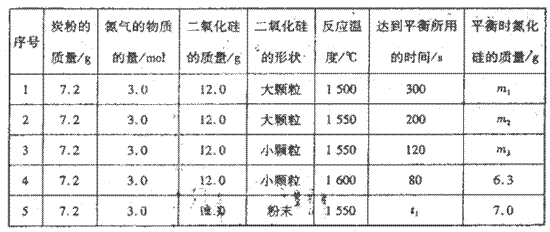
①实验l和实验2表明,________对反应速率有影响,对同一规律研究的实验还有一组是________(填实验序号)。本实验还研究了_______对反应速率的影响。。
②实验5中,t1________(填“>”、“<”或“=”)120,平衡时,二氧化硅的转化率为____________________。
参考答案:(1)放热
(2)①温度;实验3和实验4;反应物的形状;
②<;41.7%
本题解析:(1)根据题目所给信息,结合盖斯定律判断臭氧转化为氧气2O3(g)=3O2(g)的△H=-235.8 kJ/mol×2+62.2 kJ/mol×3=-285kJ/mol<0,所以该反应是放热反应;
(2)① 实验l和实验2的不同之处在于温度的不同,所以实验l和实验2表明温度对反应速率有影响;对同一规律研究的实验还有一组是实验3和实验4,只是温度不同,其他均相同;通过分析表中数据,其他条件相同而二氧化硅的形状不同,反应速率也不同,所以本实验还研究了反应物的形状对反应速率的影响;
②实验5与实验3相比,只是二氧化硅的形状不同,其余条件均相同,反应物的表面积越大,反应速率越快,粉末状比小颗粒的表面积大,所以t1<120;二氧化硅的初始量是12.0g,平衡时的质量是7.0g,所以消耗5.0g,二氧化硅的转化率是5.0g/12.0g×100%=41.7%。
本题难度:一般