1、选择题 配制一定物质的量浓度的盐酸溶液时,下列操作可使所配制溶液浓度偏高的是( )
A.用量筒量取浓盐酸俯视读数
B.溶解搅拌时有液体飞溅
C.定容时俯视容量瓶瓶颈刻度线
D.摇匀后见液面下降,再加水至刻度线
参考答案:C
本题解析:
本题难度:简单
2、填空题 (6分)实验室用固体烧碱配制500mL 0.32mol·L-1的NaOH溶液。
①需称量______ ____ g的烧碱固体,固体应放在____________中置于天平左盘称量。
②配制过程中,不需要使用的仪器是(填符号)_____________。
A烧杯 B、量筒 C、玻璃棒 D、1000mL容量瓶 E、漏斗
③根据实验的实际需要和②中列出的仪器判断,完成实验还缺少的仪器是_________ (填仪器名称)。
④由于操作上的不规范,下列使所配溶液的物质的量浓度偏低的是_________:偏高的是______:
A称量时药品和砝码位置颠倒
B称量时间过长
C、溶液未冷却即转入容量瓶
D、容量瓶洗净后未烘干
E、定容时俯视刻度线
F、定容后倒转摇匀,发现液面低于刻度线而未加水补充
参考答案:(6分)①6.4, 烧杯 ②DE ③胶头滴管 500mL容量瓶 ④AB; CE
(每空1分)
本题解析:①实验室配制500mL 0.32mol/L的NaOH溶液,需要NaOH的质量为:0.5L×0.32mol/L×40g/mol=6.4g,氢氧化钠固体具有腐蚀性,所以应放在小烧杯中称量。
②配制步骤为:计算→称量→溶解、冷却→移液→定容→摇匀→装瓶→贴签,一般用天平称量(用到药匙)称量,在烧杯中溶解,冷却后转移到500mL容量瓶中,并用玻璃棒引流,转移完毕,用少量蒸馏水洗涤烧杯及玻璃棒2~3次并将洗涤液全部转移到容量瓶中,再加适量蒸馏水,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,使溶液的凹液面的最低点与刻线相平,塞好瓶塞,反复上下颠倒摇匀,所以需要的仪器为:托盘天平、药匙、烧杯、玻璃棒、500mL容量瓶、胶头滴管,不需要的是漏斗,故选:DE。
③根据实验的实际需要和②中列出的仪器判断,完成实验还缺少的仪器是:500mL容量瓶、胶头滴管。
④A.称量时药品和砝码位置颠倒,导致称量的溶质质量减小,配制的溶液中溶质的物质的量减小,浓度偏低;B.称量时间过长,导致氢氧化钠潮解,称量的氢氧化钠的质量偏低,氢氧化钠的物质的量偏小,浓度偏低;C.溶液未冷却即转入容量瓶,导致配制的溶液的体积偏小,配制的溶液浓度偏高;D.容量瓶洗净后未烘干,定容时还需要加入蒸馏水,所以不影响配制结果;E.定容时俯视刻度线,导致配制的溶液体积偏低,浓度偏高;F.定容后倒转摇匀,发现液面低于刻度线而未加水补充,操作正确,不影响配制结果;所配溶液的物质的量浓度偏低的是:A、B;偏高的是:C、E。
考点:本题考查一定物质的量浓度溶液的配制过程、仪器以及误差分析。
本题难度:一般
3、实验题 (8分)用18mol/L的浓硫酸配制100mL 1mol/L硫酸:
(1)用量筒量取浓硫酸的体积应为 mL,将浓硫酸缓缓倒入盛水的烧杯中后__ __ (填“应该”或“不应”)用少量蒸馏水洗涤量筒2~3次并将洗涤溶液也倒入烧杯中。
(2)若实验仪器有: A.100mL量筒 B.托盘天平 C.玻璃棒 D.50mL容量瓶 E.10mL量筒 F. 胶头滴管 G. 50mL烧杯 H. 100mL容量瓶
验时应选用的仪器有(填入编号) 。
(3)定容时,若俯视液面,则所配溶液浓度 ____ (填“偏高”、“偏低”或“无影响”);若不小心加水超过了容量瓶刻度线,应 。
A.用胶头滴管将多余溶液吸出 B.加热容量瓶使水挥发 C.重新配制
参考答案:(8分)①5.6(2分),不应(1分)
②C E F G H(2分,漏选得1分,有错选不得分) ③偏高(1分),C(2分)
本题解析:(1)18mol/L的浓硫酸配制100mL 1mol/L硫酸需要浓硫酸的体积是
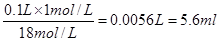 ;量取浓硫酸的量筒是不能洗涤的,否则浓度偏大。
;量取浓硫酸的量筒是不能洗涤的,否则浓度偏大。
(2)量取5.6ml浓硫酸需要10ml量筒,另外还需要稀释浓硫酸额烧杯和玻璃棒,以及100ml容量瓶和定容时需要的胶头滴管,即答案选C、E、F、G、H。
(3)根据c=n/V可知,如果定容时,俯视液面,则容量瓶中溶液的体积减少,所配溶液浓度偏高。若不小心加水超过了容量瓶刻度线,则只能是重新配制,答案选C。
考点:考查一定物质的量浓度溶液的配制、仪器的选择和误差分析
配制一定物质的量浓度溶液的实验是中学化学中一个重要的定量实验,实验过程中引起溶液浓度存在误差的因素有很多。从大的方面讲,一是由实验过程中的不规范操作引起的;二是由仪器或药品等系统原因引起的。由于引起误差的原因复杂,所以误差分析就成为高考化学实验中的一个难点。
本题难度:一般
4、选择题 NA表示阿伏加德罗常数,下列判断正确的是 ( )
A.在18 g18O2中含有2NA个氧原子
B.1 mol H2与1 mol Cl2反应生成NA个HCl分子
C.1 mol Ca变成Ca2+时失去的电子数为2NA
D.电解精炼铜时,若阴极得到电子数为2NA个,则阳极质量减少64 g