| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学必考知识点《与量有关的离子方程式的书写》考点强化练习(2017年押题版)(十)
 +Ca2++2OH-=CaCO3↓+2H2O+MgCO3↓ +Ca2++2OH-=CaCO3↓+2H2O+MgCO3↓参考答案:C 本题解析:A 不符合复分解反应发生的条件。反应不能进行。错误。B次氯酸有强的氧化性,能把亚硫酸钙氧化成硫酸钙。反应的两种方程式为:Ca2++ClO一+SO2+H2O=CaSO4↓+2H++Cl-。错误。C符合两种方程式的书写原则。正确。D.Mg2++2HCO 本题难度:一般 4、填空题 (19分)碳及其化合物有广泛的用途。 |
 2CO(g) △H=+172.5kJ?mol-1
2CO(g) △H=+172.5kJ?mol-1 ?CO2(g)+H2(g),得到如下数据:
?CO2(g)+H2(g),得到如下数据:| 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所x需时间/min | ||
| H2O | CO | H2 | CO | ||
| 900 | 1.0 | 2.0 | 0.4 | 1.6 | 3.0 |
 2NH3(g)?ΔH=-92.4kJ?mol-1。实验室模拟化工生产,分别在不同实验条件下反应,N2浓度随时间变化如下图。
2NH3(g)?ΔH=-92.4kJ?mol-1。实验室模拟化工生产,分别在不同实验条件下反应,N2浓度随时间变化如下图。 ?
?
参考答案:(1)A (2分)?
(2)C(s)+2H2O(g)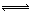 CO2(g)+2H2(g)?H="90.1" kJ?mol-1(3分)
CO2(g)+2H2(g)?H="90.1" kJ?mol-1(3分)
(3)CH3OH(g) +8OH?-6e-=CO32? +6H2O (3分)? 13(2分)
(4)K=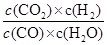 ?=
?=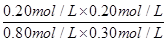 =0.17?(3分)
=0.17?(3分)
2CO2 +3OH- ===CO32- + HCO3- + H2O (3分)
(5)①使用催化剂(1分)。
②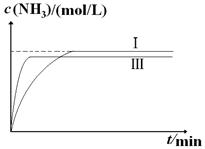 ?(2分,纵坐标起点可以大于0。Ⅲ比Ⅰ快1分,比Ⅰ少1分)
?(2分,纵坐标起点可以大于0。Ⅲ比Ⅰ快1分,比Ⅰ少1分)
本题解析:(1)A、升高温度,化学反应速率加快,正反应为吸热反应,平衡向正反应方向移动,提高H2O的平衡转化率,正确;B、碳为固体,增加碳的量,反应速率和平衡都不变,错误;C、加入催化剂,平衡不移动,错误;D、用CO吸收剂除去CO可提高H2O的平衡转化率,但反应速率减小,错误;E、增大压强,平衡向逆反应方向移动,H2O的平衡转化率减小,错误。
(2)首先写出C(s)与H2O(g)反应生成CO2(g)和H2(g)的化学方程式并注明状态,C(s)+2H2O(g)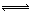 CO2(g)+2H2(g),然后根据盖斯定律求焓变,?H=2?H1—?H2="2×131.3" kJ?mol-1—172.5kJ?mol-1="90.1" kJ?mol-1,可得热化学方程式。
CO2(g)+2H2(g),然后根据盖斯定律求焓变,?H=2?H1—?H2="2×131.3" kJ?mol-1—172.5kJ?mol-1="90.1" kJ?mol-1,可得热化学方程式。
(3)甲醇在电池负极上失去电子,KOH溶液作电解质溶液,生成CO32?和H2O,配平可得电解方程式:CH3OH(g) +8OH?-6e-=CO32? +6H2O;电池和电解池通过的电量相等,根据电极方程式和电子转移可得:CH3OH ~ 6e? ~ 6OH?,则n(OH?)=6n(CH3OH)=0.06mol,则c(OH?)=0.06mol÷0.6L=0.1mol?L?1,可得pH=13。
(4)根据三段式进行计算:
H2O (g) + CO(g) 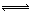 ?H2(g) + CO2(g)
?H2(g) + CO2(g)
起始浓度(mol?L?1)? 0.5? 1? 0? 0
转化浓度(mol?L?1)? 0.2? 0.2? 0.2? 0.2
平衡浓度(mol?L?1)? 0.3? 0.8? 0.2? 0.2
K=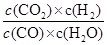 ?=
?=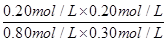 =0.17
=0.17
若CO2与NaOH的物质的量之比为1:1,生成NaHCO3,若CO2与NaOH的物质的量之比为1:2,生成Na2CO3,题目所给CO2物质的量为0.6mol,NaOH的物质的量为:0.2L×4.5mol?L?1=0.9mol,二者物质的量之比为2:3,生成CO32?和HCO3?,配平可得离子方程式:2CO2 +3OH- ===CO32- + HCO3- + H2O
(5)根据图像可知实验Ⅱ反应速率加快,但化学平衡没有移动,所以实验Ⅱ改变的条件为使用了催化剂;实验Ⅲ比实验Ⅰ的温度要高,反应速率加快,因为该反应为放热反应,所以升温平衡向逆反应方向移动,平衡时NH3的平衡浓度减小,可画出图像。
本题难度:困难
5、选择题 下列离子方程式书写正确的是
[? ]
A.?AlCl3溶液中加入过量氨水:Al3++3NH3·H2O==Al(OH)3↓+?3NH4+
B.?硫酸镁溶液与氢氧化钡溶液混合:SO42-?+?Ba2+==?BaSO4↓?
C.?Fe(NO3)3加入过量的HI溶液:2Fe3++2I-==?2Fe2++I2
D.?Cu溶于足量稀硝酸:Cu+2NO3-+4H+==Cu2++2NO2↑+2H2O
参考答案:A
本题解析:
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点总结《与量有关的.. | |