1、选择题 X、Y、Z为短周期非金属元素,其相关性质如下:
元素
| X
| Y
| Z
|
与H2反应条件
| 暗处反应
| 光照
| 高温、催化剂
|
常温下氢化物水溶液的pH
| 小于7
| 小于7
| 大于7
|
下列叙述正确的是
A.非金属性X<Y
B.Z为第VA族元素
C.最外层电子数Z>Y
D.Y、Z的氢化物反应形成离子化合物
参考答案:BD
本题解析:根据非金属元素X、Y、Z的单质与氢气反应的难易、气态氢化物水溶液的酸碱性推断,X、Y、Z分别为氟、氯、氮。氟、氯都位于第VIIA族,非金属性:F>Cl,故A错误;氮位于第VA族,故B正确;根据最外层电子数等于主族序数可知,氮、氯原子最外层电子数分别为5、7,且5<7,故C错误;氯、氮的氢化物分别为HCl、NH3,二者易反应产生白烟,生成氯化铵,NH4Cl属于离子化合物,故D正确。
本题难度:简单
2、选择题 在通常条件下,下列各组物质的性质排列正确的是(?)
A.熔点:CO2>KCl>SiO2
B.水溶性: SO2>HCl>H2S
C.还原性:HF>HCl>HBr>HI
D.热稳定性:HF>H2O>NH3
参考答案:D
本题解析:A错,熔点:SiO2>KCl>CO2;B错,水溶性:HCl>SO2>H2S;C错,还原性;HI> HBr > HCl > HF;D正确,氢化物的稳定与非金属强弱有关,非金属性越强,氢化物越稳定;
本题难度:简单
3、选择题 同主族相邻周期的A、B两种元素所在周期分别最多可排m和n种元素,且B在A的上周期,当A的原子序数为x时,B的原子序数为(? )
A、x―n? B、x+m? C、? m-n? D、x+n
参考答案:A
本题解析:考查元素周期表的结构。若AB位于周期表的左侧,则A的原子序数是B的原子序数加上B所在周期的原子个数。若AB位于周期表的右侧,则A的原子序数是B的原子序数加上A所在周期的原子个数。所以答案是A。
本题难度:简单
4、选择题 以下能级符号正确的是?(?)
A.6s
B.2d
C.3f
D.2f
参考答案:A
本题解析:略
本题难度:简单
5、填空题 有A、B、C、D四种短周期元素, 它们的原子序数由A到D依次增大, 已知A和B原子有相同的电子层数, 且A的L层电子数是K层电子数的两倍, C在空气中燃烧时呈现黄色火焰, C的单质在加热下与B的单质充分反应, 可以得到与D单质颜色相同的淡黄色固态化合物, 试根据以上叙述回答:
(1) 元素名称: B ______ ; D ______。
(2)? C元素位于周期表中?周期?族。
(3) 写出A的最高价氧化物与过量的C的最高价氧化物的水化物反应的离子方程式:
__________________________________________________________________________。
(4) 用电子式表示化合物 C2D 的形成过程:
__________________________________________________________________________。
参考答案:(12分)(1) 氧?硫? (2)?第三?ⅠA ?(3) CO2 + 2OH-=CO32-+H2O
(4)?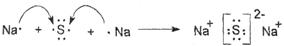
本题解析:(1)A的L层电子数是K层电子数的两倍,所以A是碳元素。C在空气中燃烧时呈现黄色火焰,所以C是钠元素。C的单质在加热下与B的单质充分反应, 可以得到与D单质颜色相同的淡黄色固态化合物,且A和B原子有相同的电子层数,所以B是氧元素,D是硫元素。
(2)钠元素的原子序数是11,则钠位于第三周期第IA族。
(3)CO2和过量的氢氧化钠溶液反应生成碳酸钠和水,反应的离子方程式是CO2 + 2OH-=CO32-+H2O。
(4)硫化钠是含有离子键的离子化合物,起形成过程是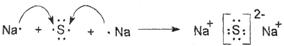 。
。
点评:该题是高考中的常见题型,属于中等难度的试题。试题基础性强,侧重对学生基础知识的巩固和训练,有利于提高学生的逻辑推理能力和应试能力。该题以“周期表中元素的推断”为载体,考查学生对元素周期表的熟悉程度及其对表中各元素性质和相应原子结构的周期性递变规律的认识和掌握程度。考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力
本题难度:一般