1、填空题 【化学与技术】
电镀厂镀铜废水中含有CN-和Cr2O72-离子,需要处理达标后才能排放。该厂拟定下列流程进行废水处理,回答下列问题:
 ?
?
(1)上述处理废水流程中主要使用的方法是______。
(2)②中反应后无气体放出,该反应的离子方程式为?。
(3)步骤③中,每处理0.4mol Cr2O72-时转移电子2.4mol,该反应离子方程式为?。
(4)取少量待测水样于试管中,加入NaOH溶液,观察到有蓝色沉淀生成,再加Na2S溶液,蓝色沉淀转化成黑色沉淀,请使用化学用语和文字解释产生该现象的原因?。
(5)目前处理酸性Cr2O72-废水多采用铁氧磁体法。该法是向废水中加入FeSO4·7H2O将Cr2O72-还原成Cr3+,调节pH,Fe、Cr转化成相当于FeII[FeCr]O4(铁氧磁体,罗马数字表示元素价态)的沉淀。处理1mol Cr2O72-,需加入a mol FeSO4?7H2O,下列结论正确的是_______。
A.x ="0.5" ,a =8
B.x =0.5,a = 10
C.x =" 1.5" ,a =8
D.x =" 1.5" ,a = 10
参考答案:(1)氧化还原法
(2)CN-+ClO-=CNO-+Cl-
(3)3S2O32-+4Cr2O72-+26H+=6SO42-+8Cr3++13H2O
(4)Cu2++2OH-=Cu(OH)2↓? Cu(OH)2(s)+S2-(aq)=CuS(s)+2OH-(aq)
因为:KSP(CuS)<KSP[Cu(OH)2]?
(5)D
本题解析:(1)由图可知,将废水中的离子实现上述转化时,利用了氧化还原反应,则主要使用的方法为氧化还原法;
(2)碱性条件下,CN-离子与NaClO发生氧化还原反应,无气体放出,则生成CNO-、Cl-离子,离子反应为CN-+ClO-═CNO-+Cl-,
(3)每0.4molCr2O72-转移2.4mol的电子,设还原后Cr元素的化合价为x,则0.4mol×2×(6-x)=2.4mol,解得x=+3,则离子反应为:
3S2O32-+4Cr2O72-+26H+═6SO42-+8Cr3++13H2O。
(4)因铜离子与氢氧根离子反应生成氢氧化铜沉淀,CuS比Cu(OH)2更难溶,则加入Na2S溶液能发生沉淀的转化,故答案为:待检水样中还有Cu2+,加碱发生Cu2++2OH-═Cu(OH)2↓,再加入Na2S溶液,CuS比Cu(OH)2更难溶,则发生Cu(OH)2(s)+S2-(aq)═CuS(s)+2OH-(aq)。
(5)设最终生成了ymol混合物,由于Cr元素量不变,则有(2-x)y=2,Fe元素不变,则有(1-x)y=a,铁失去的电子物质的量等于Cr得到的电子的物质的量相等,有x=1.5,y=4,a=10。答案选D。
本题难度:一般
2、填空题 化学学科中的化学平衡、电离平衡、水解平衡和溶解平衡均符合勒夏特列原理。
请回答下列问题:
 (1)工业上采取CO和H2为原料合成乙醇,其化学反应方程式为:2CO(g)+4H2(g)
(1)工业上采取CO和H2为原料合成乙醇,其化学反应方程式为:2CO(g)+4H2(g)
参考答案:
本题解析:
本题难度:困难
3、选择题 下列说法正确的是?( )
A.电离平衡常数受溶液浓度的影响
B.电离常数大的酸溶液中c(H+)一定比电离常数小的酸溶液中的大
C.电离平衡常数可以表示弱电解质的相对强弱
D.H2CO3的电离常数表达式:K=
参考答案:C
本题解析:电离平衡常数只受温度的影响,A错误;浓度相同时电离常数大的酸溶液中c(H+)一定比电离常数小的酸溶液中的大,B错误;H2CO3的电离常数表达式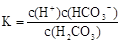 ,D项错误。答案选C。
,D项错误。答案选C。
点评:电离平衡常数只与温度有关,温度变则K变,温度不变则K不变。
本题难度:简单
4、选择题 已知Ksp(AgCl)=1.56×10-10,Ksp(AgBr)=7.7×10-13,Ksp(Ag2CrO4)=9.0×10-12,某溶液中含有C1-, Br- 和CrO42-,浓度均为0.010mo1·L-,向该溶液中逐滴加入0.010mol·L-1的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为
A.C1-、Br-、CrO42-
B.CrO42-、Br-、C1-
C.Br-、C1-、CrO42-
D.Br-、CrO42-、C1-