1、选择题 在298K、100kPa时,已知:
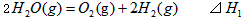
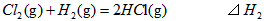
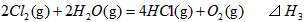
则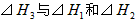 间的关系正确的是
间的关系正确的是
[? ]
A.
B.
C.
D.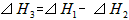 ?
?
参考答案:A
本题解析:
本题难度:一般
2、选择题 在298K、100kPa时,已知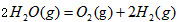 ?
?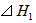

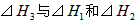 间的关系正确的是
间的关系正确的是
[? ]
A.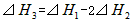
B.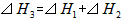
C.
D.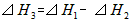
参考答案:C
本题解析:
本题难度:一般
3、简答题 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题:
(1)用CH4催化还原NOx可以消除氮氧化物的污染.例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ?mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2
若1mol?CH4还原NO2至N2,整个过程中放出的热量为867kJ,则△H2=______;
(2)工业合成氨气需要的反应条件非常高且产量低,而一些科学家采用高质子导电性的SCY陶瓷(能传递H+?)实现氨的电化学合成,从而大大提高了氮气和氢气的转化率.电化学合成氨过程的总反应式为:N2+3H2?
?2NH3,则在电化学合成氨的过程中,阴极反应式为______;
(3)在一定条件下,将l?mol?N2与3mol?H2混合于一个10L密闭容器中,反应达到平衡时,A点混合气体中氨占25%,
试回答:①N2的转化率为______;
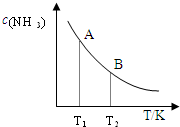
②右图中在状态A时,平衡常数?KA______(填写代入数值的表达式,不要求算出具体数值);当温度由T1变化到T2时,KA______?KB(填“>”、“<”或“=”).
③在容积固定的密闭容器中发生上述反应,各物质的浓度如下表:
时间/min
浓度/mol.L | c?(N2) | c?(H2) | c?(NH3)
0
0.6
1.8
0
3
0.52
x
0.16
6
0.36
1.08
0.48
9
0.36
1.08
0.48
|
反应从0min到3min之间,H2的反应速率为______;反应在3min时,条件发生了改变,改变的条件可能是______?(填序号).
a.使用催化剂?b.降低温度?c.增加H2的浓度.
参考答案:(1)CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ?mol-1? ①
? CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2?②
根据盖斯定律得:2CH4(g)+4NO2(g)=2CO2(g)+4H2O(g)+2N2(g)△H1+△H2?
而?1mol?CH4还原NO2至N2,整个过程中放出的热量为867kJ,所以△H1+△H2=-1734kJ?mol-1,则△H2=-1734kJ?mol-1+574kJ?mol-1=-1160?kJ?mol-1,故答案为:-1160kJ?mol-1;?
(2)阴极得电子发生还原反应:N2+6H++6e-=2NH3,故答案为:N2+6H++6e-=2NH3
(3)①N2 +3H2? ?通电?.一定条件? ?2NH3
起始(mol)? ?1?3? 0
反应(mol)? ?a?3a? ?2a
平衡(mol)?1-a?3-3a? 2a
因混合气体中氨占25%,则?2a(1-a)+(3-3a)+?2a×100%=25%,解得:a=0.4,
N2的转化率为0.4?1?×100%=40%,故N2的转化率为40%;
②平衡常数?KA=C2(NH3)C(N2?)C3(H2)=0.0820.06×0.183,故答案为:0.0820.06×0.183;升高温度平衡向吸热的方向移动,即逆反应方向移动,平衡常数减小,故答案为:>;
③N2的反应速率为V=△C△t=0.083mol?L-1?min-1,而V(H2)=3V(N2)=0.08?mol?L-1?min-1,
故答案为:0.08?mol?L-1?min-1;
③根据表可知第2min是平衡建立过程,反应速率加快,H2的量没有增加,根据外界条件对化学反应速率的影响,可知使用催化剂、升高温度均可,增加H2的浓度是不可,故选:a;
本题解析:
本题难度:一般
4、填空题 能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。(注:“原子经济性”是指,在化学品合成过程中,合成方法和工艺应被设计成能把反应过程中所用的所有原材料尽可能多的转化到最终产物中)
(1)工业上一般采用下列两种反应合成甲醇
反应I:?CO(g)?+?2H2(g) CH3OH(g)?ΔH1 ?
CH3OH(g)?ΔH1 ?
反应II:?CO2(g)?+?3H2(g) CH3OH(g)?+?H2O(g)?ΔH2 ?
CH3OH(g)?+?H2O(g)?ΔH2 ?
上述反应符合“原子经济”原则的是________(填“I”或“Ⅱ”)。
(2)已知在常温常压下:
①?2CH3OH(l)?+?3O2(g)?=?2CO2(g)?+?4H2O(g)?ΔH?=?-1275.6?kJ·mol-1
②?2CO?(g)+?O2(g)?=?2CO2(g)?ΔH?=?-566.0?kJ·mol-1
③?H2O(g)?=?H2O(l)?ΔH?=?-44.0?kJ·mol-1
请写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式 ___________________
(3)甲醇--空气燃料电池,电解质溶液是:20%~30%的KOH溶液。请写出甲醇--空气燃料电池放电时正极的电极反应式。___________________。
(4)下图是一个电化学过程示意图。
①?锌片上发生的电极反应式为___________。
②?假设使用甲醇--空气燃料电池作为本过程中的电源,铜片的质量变化96g,则燃料电池理论上需要___________mol甲醇。
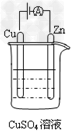
参考答案:(1)I?
(2)CH3OH(l)?+?O2(g)?=?CO(g)?+?2H2O(l)?ΔH?=?-442.8kJ·mol-1
(3)?O2+2H2O+4e-=4OH-
(4)?①Cu2++2e-=Cu;②0.5?mol
本题解析:
本题难度:一般
5、简答题 (1)真空碳热还原-氯化法可实现由铝土矿制备金属铝,相关反应的热化学方程式如下:
Al2O3(s)+AlCl3(g)+3C(s)═3AlCl(g)+3CO(g)△H=a?kJ-mol-1
3AlCl(g)═2Al(l)+AlCl3(g)△H=b?kJ-mol-1
①反应Al2O3(s)+3C(s)═2Al(l)+3CO(g)的△H=______kJ-mol-1(用含a、b的代数式表示).
②Al4C3是反应过程中的中间产物.Al4C3与盐酸反应(产物之一是含氢量最高的烃)的化学方程式为______.
(2)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜.已知:
Cu(s)+2H+(aq)═Cu2+(aq)+H2(g)△H=+64.39kJ-mol-1
2H2O2(aq)═2H2O(l)+O2(g)△H=-196.46kJ-mol-1
H2(g)+
O2(g)═H2O(l)△H=-285.84kJ-mol-1
则H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式为______.
参考答案:(1)①上述两式相加可得:Al2O3(s)+3C(s)═2Al(l)+3CO(g)的△H=(a+b)kJ?mol,故答案为:a+b;
②Al4C3与盐酸反应的化学方程式:Al4C3+12HCl═4AlCl3+3CH4↑,故答案为:Al4C3+12HCl═4AlCl3+3CH4↑;
(2)利用盖斯定律,将①+12×②+③可得:Cu(s)+H2O2(l)+H2SO4(aq)=CuSO4(aq)+2H2O(l),△H=-319.6 kJ/mol,
故答案为:Cu(s)+H2O2(l)+H2SO4(aq)=CuSO4(aq)+2H2O(l)△H=-319.6 kJ/mol.
本题解析:
本题难度:一般