1、填空题 (15分)
A、B、C、D都是中学化学中的常见化合物,均由周期表前18号元素组成,D为红综色气体,甲、乙则是两种单质,以上单质和化合物之间在如图1所示的反应关系(反应物和生成物均无省略)。

请回答下列问题:
(1)图1所示转化过程中包含的反应类型有?(填字母)。
a.置换反应? b.复分解反应? c.分解反应? d.化合反应
(2)图1中反应①的化学方程式是?。(3分)
(3)图1中反应③在一定条件下为可逆反应,反应的能量变化如图2所示,当该反应处于平衡状态时,下列措施中有利于提高C的平衡转化率的是?(填字母)。
A.升高温度? B.降低温度? C.增大压强
D.减小压强? E.加入催化剂? F.增加C的量
(4)若将l.00 mol甲和2.00 mol C混合充入容积为2 L的密闭容器中,3分钟后反应达到平衡。平衡后混合气体总物质的量为2.55mol,用甲表示的化学反应速率为
?mol?L-1?min-1。
(5)容积均为2 L的四个密闭容器中均进行着(4)中的反应,某温度下,各物质物质的量(mol)及正逆反应速率关系如下表所示:
容器编号
| n(甲)
| n(C)
| n (D)
| v正与v逆的关系
|
Ⅰ
| 0.20
| 0.10
| 0.20
| v正=v逆
|
Ⅱ
| 0.20
| 0.40
| 1.00
| ②?
|
Ⅲ
| 0.60
| 1.20
| 0.80
| ③?
|
①若方程式系数为最简整数比,则该温度下的平衡常数K=?
填写表中空格:?②??③?
参考答案:(1) c、d(各1分,写错1个扣1分,扣完2分止)
(2)4NH3+5O2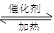 ?4NO + 6H2O(3分)
?4NO + 6H2O(3分)
(3)? B、C (各1分,写错1个扣1分,扣完2分止)
(4)? 0.075(2分)
(5)?①40(2分)?②<(2分)?③>(2分)
本题解析:D为红综色气体,则D是NO2。因此反应③是NO和氧气发生的氧化还原反应,即甲是氧气,C是NO。氧气和B反应生成物也是NO,这说明B是氨气,反应①属于氨的催化氧化,则A是H2O,电解水得到氢气和氧气,属于乙是氢气。
(1)②③分别是分解反应和化合反应,①是氧化还原反应。
(2)氨气发生催化氧化的反应式为4NH3+5O2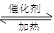 ?4NO + 6H2O
?4NO + 6H2O
(3)反应③的反应式为2NO+O2 2NO2,根据图像可判断,反应是放热反应。所以要提供转化率可以通过降低温度,或增大压强来提供转化率。催化剂不能影响平衡状态,转化率不变,增加C的物质的量,平衡向正反应方向移动,但C的转化率会降低。
2NO2,根据图像可判断,反应是放热反应。所以要提供转化率可以通过降低温度,或增大压强来提供转化率。催化剂不能影响平衡状态,转化率不变,增加C的物质的量,平衡向正反应方向移动,但C的转化率会降低。
(4)? 2NO+O2 2NO2
2NO2
起始量(mol)? 2? 1? 0
转化量(mol)? 2x? x? 2x
平衡量(mol)? 2-2x 1-x? 2x
所以有2-2x+1-x+2x=2.55
解得x=0.45mol
所以用甲表示的化学反应速率为
(5)正逆反应速率相等,说明反应达到平衡状态,所以平衡常数为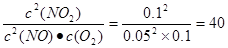 。在Ⅱ
。在Ⅱ
 >40,所以正反应速率小于逆反应速率。在Ⅲ
>40,所以正反应速率小于逆反应速率。在Ⅲ
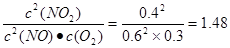 <40,所以正反应速率大于逆反应速率。
<40,所以正反应速率大于逆反应速率。
本题难度:一般
2、选择题 关于下列各图的叙述,正确的是(?)
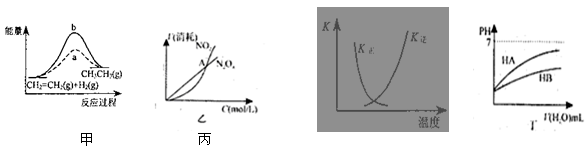
A.图甲中a、b曲线分别表示反应CH2=CH2 (g) + H2(g)→CH3CH3(g);ΔH< 0使用和未使用催化剂时,反应过程中的能量变化
B.图乙表示恒温恒容条件下发生的可逆反应2NO2(g)  N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
C.图丙中曲线表示反应2SO2(g) + O2(g)  2SO3(g);ΔH < 0 正、逆反应的平衡常数K
2SO3(g);ΔH < 0 正、逆反应的平衡常数K
随温度的变化
D.图丁中起始时HA的物质的量浓度大于HB
参考答案:C
本题解析:使用催化剂不改变平衡的移动,但是可以缩短平衡时间,反应过程中活化能降低,△H>0,A错误。图乙表示恒温恒容条件下发生的可逆反应2NO2(g)  ?N2O4(g)中,各物质的浓度与其消耗速率之间的关系,物质浓度在改变,不是平衡状态,B错误。平衡常数都和温度有关,温度升高,常数变大,C正确。图丁中起始时HA的物质的量浓度等于HB,D错误。
?N2O4(g)中,各物质的浓度与其消耗速率之间的关系,物质浓度在改变,不是平衡状态,B错误。平衡常数都和温度有关,温度升高,常数变大,C正确。图丁中起始时HA的物质的量浓度等于HB,D错误。
本题难度:简单
3、填空题 (8分)在某温度下,将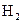 和
和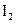 各0.1mol的气态混合物充入10L的密闭容器中,充分反应,连续测定
各0.1mol的气态混合物充入10L的密闭容器中,充分反应,连续测定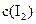 的变化,5S时测定
的变化,5S时测定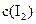 =0.0080mol/L并保护不变。
=0.0080mol/L并保护不变。
(1)反应在达到平衡过程中,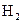 的平均消耗速率为?mol/L·S;
的平均消耗速率为?mol/L·S;
(2)反应的平衡常数的表达式是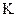 =?;
=?;
(3)此温度下,平衡常数值为?;
(4)若在此温度下,在10L的密闭器充入0.2molHI气体,达到平衡时,HI的转化率为?。
参考答案:(1) 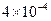 ?(2)
?(2)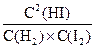 ?
?
(3) 0.25? (4) 80%
本题解析:解:(1)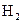 和
和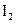 的反应方程式为:
的反应方程式为: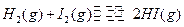
由速率公式: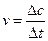
 得
得

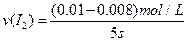
=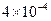
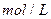
∵化学反应速率之比与方程式中的系数比是一个正比关系
∴
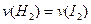 =
=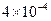
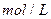
(2)平衡常数就是在一定温度下,当一个可逆反应达到平衡状态时,生成物浓度的方次乘积与反应物浓度的方次乘积的比值,用K表示。所以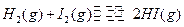 的K的表达式为
的K的表达式为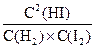 。
。
(3)解:设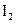 浓度的变化为xmol/L.
浓度的变化为xmol/L. 
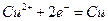
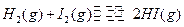
始(mol/L)? 0.01? 0.01
变? x? x? 2x
平? 0.01-x? 0.0080? 2x
依题可列等式: 0.01-x=0.0080
X=0.002(mol/L)
K=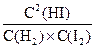 =
=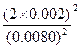 =0.25
=0.25
(4) 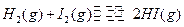 是一个体积不变的可逆反应,在恒温恒容条件下,充入0.2molHI与题给条件下的平衡建立一个等同的等效平衡。设HI变化2
是一个体积不变的可逆反应,在恒温恒容条件下,充入0.2molHI与题给条件下的平衡建立一个等同的等效平衡。设HI变化2 ymol.
ymol.
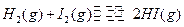
始(mol)? 0? 0? 0.2
变? y? y? 2y
平?0.080? 0.080? 0.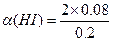 2-2y
2-2y
依题可列等式: y=0.0080(mol/L)
∴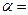
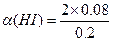 =80%
=80%
本题难度:简单
4、填空题 经过长期实践,人们总结出反应速率和反应物浓度间的定量关系:在恒温下,对简单反应来说,化学反应速率同反应物浓度方次乘积成正比(反应物浓度的方次,等于反应式中各化学式前的化学计量数)。如:对于反应式mA+Nb====C,v=K[A]m·[B]m(其中K为常数)。
今有一反应aA+bB====C,在25 ℃时,将A、B溶液按不同浓度混合,得下列实验数据:
A的浓度/mol·L-1
| B的浓度/mol·L-1
| 反应速率/mol·L-1·s-1
|
1.0
| 1.0
| 1.2×10-2
|
1.0
| 4.0
| 1.92×10-1
|
4.0
| 1.0
| 4.8×10-2
|
分析以上数据,求出a、b的值:a=_________________,b=_________________。
参考答案:1? 2
本题解析:由题意可知:v=K[c(A)]a·[c(B)]b,将第一组数据代入上式得:K=1.2×10-2;将第二组数据代入得b=2;将第三组数据代入得a=1。
本题难度:简单
5、选择题 在一定温度下,向aL密闭容器中加入1molX气体和2molY气体,发生如下反应:X(g)+2Y(g)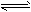 2Z(g),此反应达到平衡的标志是
2Z(g),此反应达到平衡的标志是
[? ]
A.容器内气体密度不随时间变化
B.v正(X): v逆(Y)= l:2
C.容器内X、Y、Z的浓度之比为1:2:2
D.单位时间消耗0.1 molX同时生成0.2molZ
参考答案:B
本题解析:
本题难度:一般