1、填空题 (12分)对碳及其氧化物的化学热力学、动力学研究有助于人类充分利用化石燃料,消除碳氧化物对环境的负面影响。请回答下列问题:
(1) 25℃时,石墨和CO的燃烧热分别为:393.5kJ/mol、283.0kJ/mol。请写出石墨不完全燃烧时的热化学方程式??;
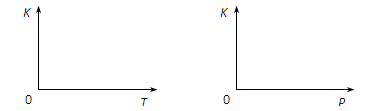
(2)25℃时,反应2CO2 (g) 2CO(g)+O2(g)的平衡常数K=2.96×10-92。在一个体积可变的密闭容器(起始时的容器体积为1L)中充入一定量的CO2、CO、O2混合气体,要使容器中的反应开始时向CO2分解的方向移动,则起始时充入的三种气体的物质的量应满足的关系是?。当该反应在25℃时达到平衡后,其它条件不变时,升高温度或增加容器的压强,均能使该平衡发生移动,请在下列坐标中作出该反应的平衡常数K随温度(T)、压强(P)变化而变化的示意图:
2CO(g)+O2(g)的平衡常数K=2.96×10-92。在一个体积可变的密闭容器(起始时的容器体积为1L)中充入一定量的CO2、CO、O2混合气体,要使容器中的反应开始时向CO2分解的方向移动,则起始时充入的三种气体的物质的量应满足的关系是?。当该反应在25℃时达到平衡后,其它条件不变时,升高温度或增加容器的压强,均能使该平衡发生移动,请在下列坐标中作出该反应的平衡常数K随温度(T)、压强(P)变化而变化的示意图:
(3) 1?600℃时,反应2CO(g)+O2(g)  2CO2(g)的平衡常数K=1×108。经测定,汽车尾气中CO和CO2气体的浓度分别为4.0×10-5mol/L和4.0×10-4mol/L。若在汽车的排气管上增加一个1?600℃的补燃器并不断补充O2使其浓度始终保持为4.0×10-4mol/L。则CO的补燃转化率为?;
2CO2(g)的平衡常数K=1×108。经测定,汽车尾气中CO和CO2气体的浓度分别为4.0×10-5mol/L和4.0×10-4mol/L。若在汽车的排气管上增加一个1?600℃的补燃器并不断补充O2使其浓度始终保持为4.0×10-4mol/L。则CO的补燃转化率为?;
(4)以CO和O2为电极燃料,以熔融K2CO3为电解质组成燃料电池,请写出该电池的负极反应方程式?。
2、选择题 若过程I与过程II温度相同,则关于反应N2O4(g) 2NO2 (g)在下列过程中发生的变化描述正确的是
2NO2 (g)在下列过程中发生的变化描述正确的是
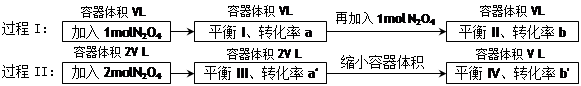
A.a" < b"、a > b
B.在平衡I向平衡II过渡的过程中,v(逆) < v(正)
C.a" > a、b" < b
D.平衡II与平衡IV中N2O4的质量分数相等
3、选择题 利用下列反应可以将粗镍转化为纯度达99.9%的高纯镍。
反应一:Ni(粗,s)+4CO(g)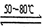 Ni(CO)4(g)? ΔH < 0
Ni(CO)4(g)? ΔH < 0
反应二:Ni(CO)4(g)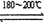 Ni(纯,s)+4CO(g)? ΔH > 0
Ni(纯,s)+4CO(g)? ΔH > 0
下列说法错误的是
A.对于反应一,适当增大压强,有利于Ni(CO)4的生成
B.提纯过程中,CO气体可循环使用
C.升高温度,反应一的反应速率减小,反应二的速率增大
D.对反应二,在180—200℃,温度越高,Ni(CO)4(g)的转化率越高
4、填空题 (1)钒触媒(V2O5)能加快SO2的氧化速率,此过程中SO2先与V2O5反应生成V2O4。该过程的化学方程式可表示为__________________________________________。
(2)为测定过程中混合气的SO2体积分数,选用0.0500 mol/L I2的标准溶液、淀粉溶液进行测定。已知:V(耗用I2标准溶液)="10.00" mL,V(采集烟气)="100.0" mL(已折算为标准状况),则烟气中SO2?的体积分数为_____________________。
(3)一定温度时,SO2的平衡转化率(α)与体系总压强(p)的关系如图9所示。试分析工业生产中采用常压的原因是____________________。
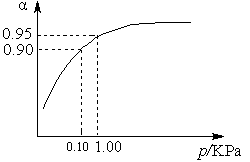
图9
(4)在温度相同、体积均为1 L的三个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下。
已知:2SO2(g)+O2(g) 2SO3(g)?ΔH ="-98.3" kJ·mol-1。
2SO3(g)?ΔH ="-98.3" kJ·mol-1。
容?器
| 甲
| 乙
| 丙
|
反应物投入量
| 2 mol SO2、1 mol O2
| 2 mol SO3
| m mol SO2、n mol O2、
p mol SO3
|
c(SO3) /mol·L-1
| 1.4
| 1.4
| 1.4
|
能量变化
| 放出a kJ
| 吸收b kJ
| 吸收c kJ
|
SO2或SO3的转化率
| α1
| α2
| 12.5%
|
?
则:α1+α2=_________________,p=________________mol,b+c=_______________kJ。
5、填空题 工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:CO(g)+2H2(g)?CH3OH(g)
(1)判断反应达到平衡状态的依据是(填字母序号,下同)______.
A.生成CH3OH的速率与消耗CO的速率相等
B.混合气体的密度不变
C.混合气体的相对平均分子质量不变
D.CH3OH、CO、H2的浓度都不再发生变化
(2)如表所列数据是反应在不同温度下的化学平衡常数(K).
| 温度 | 250℃ | 300℃ | 350℃
K
2.041
0.270
0.012
|
①由表中数据判断该反应的△H______0(填“>”、“=”或“<”);
②某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.2mol/L,则CO的转化率为______,此时的温度为______.
(3)要提高CO的转化率,可以采取的措施是______.
a.升温b.加入催化剂c.增加CO的浓度
d.加入H2加压e.加入惰性气体加压f.分离出甲醇
(4)一定条件下,CO与H2在催化剂的作用下生成5molCH3OH的能量变化为454kJ.在该温度时,在容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
| 容器 | 甲 | 乙 | 丙
|
反应物投入量
1molCO、2molH2
1molCH3OH
2molCH3OH
|
平衡时数据
CH3OH的浓度(mol/L)
c1
c2
c3
反应的能量变化
akJ
bkJ
ckJ
体系压强(Pa)
p1
p2
p3
反应物转化率
α1
α2
α3
|
下列说法正确的是______.
A.2c1>c3B.a+b<90.8C.2p2<p3D.α1+α3<1.