1、选择题 下列判断中,正确的是(?)
A.30%和H2O2溶液中加入MnO2可制得O2,MnO2做氧化剂
B.SO2和CO2都属于酸性氧化物,Na2O和Al2O3都属于碱性氧化物[
C.在NH4Cl水溶液中,既存在水解平衡,又存在电离平衡
D.O2在放电条件下生成O3属于化学变化,煤干馏得到焦炭属于物理变化
2、选择题 下列有关说法正确的是(? )
A.已知△G=△H-T△S, △G <0反应自发进行,2CO(g)+2NO(g) =N2(g)+2CO2(g)在温度为298℃时能自发进行,则它的△H>0
B.0.1 mol·L-1Na2CO3溶液加蒸馏水稀释,CO32-的水解程度变大,溶液的pH不断增大
C.电解精炼铜过程中,阳极质量的减少量与阴极质量的增加量一定相等
D.C(s)+CO2(g)  2CO(g) ⊿H>0,其他条件不变时升髙温度,CO2的反应速率和平衡转化率均增大
2CO(g) ⊿H>0,其他条件不变时升髙温度,CO2的反应速率和平衡转化率均增大
3、填空题 (13分)(1)常温下,0.05mol/L硫酸溶液中,c(H+)=?mol/L,pH值为?,水电离的c(H+)=?mol/L。如图所示,一定温度下,冰醋酸加水稀释过程中溶液的导电能力曲线图,请回答。

(2)“O”点为什么不导电?。
(3)a、b、c三点的氢离子浓度由小到大的顺序为?。
(4)a、b、c三点中,醋酸的电离程度最大的一点是?。
(5)若使c点溶液中的c(CH3COO-)提高,在如下措施中,可选择?。
A.加NaCl溶液?B.加热?
C.加固体KOH?D.加Zn粒
E.加固体CH3COONa ? F.加水
(6)在稀释过程中,随着醋酸浓度的降低,下列始终保持增大趋势的量是__________________。
A.H+个数?B.c(H+)
C.c(H+)/c(CH3COOH)? D.CH3COOH分子数
4、填空题 一定温度下,向如图所示带有可移动活塞的密闭容器中充入2 L SO2和1 L O2的混合气体,发生如下反应2 SO2 (g) + O2 (g)  2 SO3 (g) 。
2 SO3 (g) 。
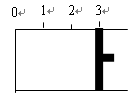
(1)若活塞可自由移动,平衡后,活塞停止在“2.1”处,则该反应中SO2的转化率为____?____。
(2)若开始时,充入容器的起始物质分别是
①2 L SO2和1 L O2;
②2 L SO3 (g) 和 1 L N2 ;
③1 L SO2、1 L O2和 1 L SO3 (g),
使活塞固定在“3”处,达到平衡后,容器中SO3 (g)占反应混合物的体积分数的大小关系是:
?(用序号和“<”、“=”、“>”表示)。
(3)向(1)平衡后的容器中充入0.2 mol 的SO3,活塞移动后再次达到平衡时,测得此过程中从外界共吸收了1.96 kJ 的热量。
写出SO2发生氧化反应的热化学方程式:________?。
5、填空题 700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g)  CO2+H2(g)反应过程中测定的部分数据见下表(表中t1>t2):
CO2+H2(g)反应过程中测定的部分数据见下表(表中t1>t2):
反应时间/min
| n(CO)/mol
| n(H2O)/ mol
|
0
| 1.20
| 0.60
|
t1
| 0.80
| ?
|
t2
| ?
| 0.20
|
依据题意回答下列问题:
(1)反应在t1min内的平均速率为v(H2)=?mol·L-1·min-1
(2)保持其他条件不变,起始时向容器中充入0.60molCO和1.20 molH2O,到达平衡时,n(CO2)=?mol。
(3)保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,达到新平衡时CO转化率?(填“增大”或“减小”或“不变” 下同),H2O的体积分数?
(4)温度升至800℃,该反应平衡常数为0.64,则正反应为?反应(填“放热”或“吸热”)。