1ЎўјтҙрМв №ӨТөәПіЙ°ұөД·ҙУҰЈЁN2+3H3ЁT2NH3Ј©КЗТ»ёц·ЕИИ·ҙУҰЈ®
ЈЁ1Ј©ПаН¬МхјюПВЈ¬1molN2әН3molH2ЛщҫЯУРөДДЬБҝ______ЈЁМоЎ°ЈҫЎұЎўЎ°ЈјЎұ»тЎ°=ЎұЈ©2molNH3ҫЯУРөДДЬБҝЈ»ФЪПаН¬МхјюПВЈ¬Иф¶ПҝӘ1molN2Ўў3molH2әН2molNH3ЦРөД»ҜС§јьКұЈ¬ОьКХөДДЬБҝ·ЦұрОӘQ1ЎўQ2ЎўQ3Ј¬ФтQ1+Q2______Q3ЈЁМоЎ°ЈҫЎұЎўЎ°ЈјЎұ»тЎ°=ЎұЈ©Ј»ФЪТ»¶ЁМхјюПВЈ¬өұёГ·ҙУҰЙъіЙ2molNH3КұЈ¬·Еіц92kJөДИИБҝЈ¬ёГМхјюПВЈ¬Из№ыҪ«1molN2әН3molH2»мәПЈ¬К№Ждід·Ц·ҙУҰЈ¬·ЕіцөДИИБҝ______92kJЈЁМоЎ°ЈҫЎұЎўЎ°ЈјЎұ»тЎ°=ЎұЈ©Ј®
ЈЁ2Ј©КөСйКТДЈДв№ӨТөәПіЙ°ұКұЈ¬ПтГЬұХИЭЖчДЪідИл10molN2Ўў30molH2Ј¬ФЪТ»¶ЁМхјюПВ·ўЙъ·ҙУҰЈ®
ўЩИфГЬұХИЭЖчөДМе»эОӘ2LЈ¬·ҙУҰҫӯ№э10minәуЈ¬ІвөГИЭЖчДЪөДNH3ОӘ10molЈ¬ФтУГN2ұнКҫөДёГ·ҙУҰЛЩВКОӘ______Ј¬ҙЛКұИЭЖчДЪH2өДЕЁ¶ИОӘ______Ј®
ўЪИфұЈіЦИЭЖчөДИЭ»эІ»ұдЈ¬·ҙУҰТ»¶ОКұјдәуЈ¬ІвөГИЭЖчДЪПВБРёчПоРФЦКұЈіЦІ»ұдЈ®ЖдЦРІ»ДЬЛөГчәПіЙ°ұ·ҙУҰТСҫӯҙпөҪ»ҜС§ЖҪәвЧҙМ¬өДКЗ______Ј®
aЈ®С№ЗҝbЈ®ГЬ¶ИcЈ®·ЦЧУКэdЈ®ЖшМеМе»эeЈ®ЖшМеЦКБҝfЈ®NH3өДОпЦКөДБҝөД·ЦКэЈ®
ІОҝјҙр°ёЈәЈЁ1Ј©·ҙУҰ·ЕИИЈ¬Фт·ҙУҰОпөДЧЬДЬБҝҙуУЪЙъіЙОпөДЧЬДЬБҝЈ¬ЛщТФПаН¬МхјюПВЈ¬1molN2әН3molH2ЛщҫЯУРөДДЬБҝҙуУЪ2molNH3ҫЯУРөДДЬБҝЈ»»ҜС§·ҙУҰЦРЈ¬»ҜС§јь¶ПБСОьКХДЬБҝЈ¬РОіЙРВ»ҜС§јь·ЕіцДЬБҝЈ¬·ҙУҰ·ЕИИЈ¬Фт¶ПБС·ҙУҰОпОьКХөДЧЬДЬБҝРЎУЪРОіЙЙъіЙОпРВ»ҜС§јьөДЧЬДЬБҝЈ»ёГ·ҙУҰОӘҝЙДж·ҙУҰЈ¬І»ДЬНкИ«ЧӘ»ҜЈ¬Ҫ«1molN2әН3molH2·ЕФЪ·ҙУҰИЭЖчЦРЈ¬К№ЛьГЗід·Ц·ҙУҰЈ¬ЙъіЙNH3өДРЎУЪ2molЈ¬·ЕіцөДИИБҝРЎУЪ92kJЈ¬
№Кҙр°ёОӘЈәЈҫЈ¬ЈјЈ¬ЈјЈ»
ЈЁ2Ј©ўЩvЈЁNH3Ј©=10mol 2L10min=0.5molЈ®L-1Ј®min-1Ј¬УЙ·ҪіМКҪҝЙЦӘЈә
vЈЁN2Ј©=12vЈЁNH3Ј©=12ЎБ0.5molЈ®L-1Ј®min-1=0.25molЈ®L-1Ј®min-1Ј¬
ёщҫЭ·ҙУҰөД·ҪіМКҪҝЙЦӘЈ¬ҙЛКұИЭЖчДЪH2өДЕЁ¶ИОӘ30mol-15mol2L=7.5mol/LЈ¬
№Кҙр°ёОӘЈә0.25molЈ®L-1Ј®min-1Ј¬7.5molЈ®L-1Ј»
ўЪ·ҙУҰҙпөҪЖҪәвЧҙМ¬КұЈ¬ХэДж·ҙУҰЛЩВКПаөИЈ¬ёчОпЦКөДЕЁ¶ИІ»ұдЈ¬С№ЗҝІ»ұдЈ¬ө«ИЭЖчөДМе»эІ»ұдЈ¬ЗТ·ҙУҰЧсСӯЦКБҝКШәг¶ЁВЙЈ¬ФтОЮВЫКЗ·сҙпөҪЖҪәвЧҙМ¬Ј¬ЖшМеөДМе»эЎўГЬ¶ИәНЦКБҝ¶јІ»ұдЈ¬І»ДЬЧчОӘЕР¶ПКЗ·сҙпөҪЖҪәвЧҙМ¬өДТАҫЭЈ®
№Кҙр°ёОӘЈәbdeЈ®
ұҫМвҪвОцЈә
ұҫМвДС¶ИЈәТ»°г
2ЎўСЎФсМв ТСЦӘ:
ўЩNH3(g)+HCl(g)==NH4Cl(s) ЎчH1=-176 kJЎӨmol-1
ўЪNH3 (g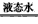 (aq) ЎчH2=-35.1 kJЎӨmol-1
(aq) ЎчH2=-35.1 kJЎӨmol-1
ўЫHCl(g)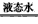 HCl(aq) ЎчH3=-72. 3 kJЎӨmol-1
HCl(aq) ЎчH3=-72. 3 kJЎӨmol-1
ўЬNH3 (aq) +HCl(aq)==NH4Cl(aq) ЎчH4=-52. 3 kJЎӨmol-1
ўЭNH4Cl(s)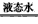 NH4Cl(aq) ЎчH5
NH4Cl(aq) ЎчH5
ФтөЪўЭёцИИ»ҜС§·ҪіМКҪЦРЎчH5ОӘ
[? ]
A. +16.3 kJЎӨmol-1
B. -16.3 kJЎӨmol-1
C. +335.7 kJЎӨmol-1
D. -335.7 kJЎӨmol-1
ІОҝјҙр°ёЈәA
ұҫМвҪвОцЈә
ұҫМвДС¶ИЈәТ»°г
3ЎўСЎФсМв ТСЦӘ3Ј®6gМјФЪ6Ј®4gөДСхЖшЦРИјЙХЈ¬ЦБ·ҙУҰОпәДҫЎЈ¬Іў·ЕіцX kJИИБҝЎЈТСЦӘөҘЦКМјөДИјЙХИИОӘ
-YkJ/molЈ¬ФтCУл1molO2·ҙУҰЙъіЙCOКұөД·ҙУҰИИҰӨHОӘ
[? ]
AЈ®ЈӯY kJ/mol
BЈ®Јӯ(10XЈӯY) kJ/mol
CЈ®Јӯ(5XЈӯ0Ј®5Y) kJ/mol
DЈ®Ј«(10XЈӯY) kJ/mol
ІОҝјҙр°ёЈәB
ұҫМвҪвОцЈә
ұҫМвДС¶ИЈәТ»°г
4ЎўјЖЛгМв УЙДЬБҝЕРҫЭ(ТФмКұдОӘ»щҙЎ)(·ыәЕОӘЎчHЈ¬өҘО»ОӘkJ/mol)әНмШЕРҫЭ(·ыәЕОӘЎчSЈ¬өҘО»ОӘJЎӨmol-1ЎӨK-1)ЧйәП¶шіЙөДёҙәПЕРҫЭЈ¬јҙМеПөЧФУЙДЬұд»Ҝ(·ыәЕОӘЎчGЈ¬өҘО»ОӘkJ/mol)Ҫ«ёьККәПУЪЛщУР№эіМөДЧФ·ўРФЕР¶ПЎЈ№«КҪОӘЎчG=ЎчH-TЎчS(TЦёҝӘ¶ыОДОВ¶И)Ј»ИфЎчGЈј0Ј¬·ҙУҰЧФ·ўҪшРРЎЈөзЧУ№ӨТөЦРЗеПҙ№иЖ¬ЙПөДSiO2(s)өД·ҙУҰКЗЈәSiO2(s)+4HF(g)==SiF4(g)+2H2O(g) ЎчH(298Ј®15K)=-94Ј®0kJЎӨmol-1 ЎчS(298Ј®15K)=-75Ј®8JЎӨmol-1ЎӨK-1 ЙиЎчHәНЎчSІ»ЛжОВ¶И¶шұд»ҜЈ¬КФЗуҙЛ·ҙУҰЧФ·ўҪшРРөДОВ¶ИМхјюЎЈ
ІОҝјҙр°ёЈәРЎУЪ1240K
ұҫМвҪвОцЈә
ұҫМвДС¶ИЈәТ»°г
5ЎўСЎФсМв ід·ЦИјЙХТ»¶ЁБҝөД¶ЎНйЈЁC4H10Ј©·ЕіцИИБҝОӘQЈ¬ҫӯІв¶ЁНкИ«ОьКХЛьЙъіЙөДCO2РиТӘПыәД5mol/LKOHИЬТә100mlЈ¬ЗЎәГЙъіЙХэСОЈ®ФтИјЙХ1mol¶ЎНй·ЕіцөДИИБҝОӘЈЁЎЎЎЎЈ©
AЈ®4Q
BЈ®5Q
CЈ®8Q
DЈ®16Q
ІОҝјҙр°ёЈәD
ұҫМвҪвОцЈә
ұҫМвДС¶ИЈәТ»°г