1、填空题 某课外活动小组用如图所示的实验装置探究氯气与氨气之间的反应.其中A、F为氨气和氯气的发生装置,C为纯净、干燥的氯气与氨气反应的装置.
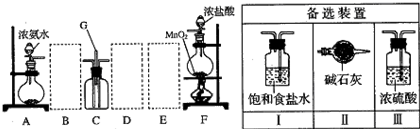
请回答下列问题:
(1)装置F中发生反应的离子方程式是______.
(2)装置A中的烧瓶内固体可选用______(选填以下选项的代号).
A.碱石灰?B.浓硫酸?C.生石灰?D.五氧化二磷?E.烧碱
(3)虚线框内应添加必要的除杂装置,请从右图的备选装置中选择,并将编号填入下列空格.B______、D______、E______.
(4)氯气和氨气在常温下混合就能发生反应生成氯化铵和氮气,该反应的化学方程式为:______;装置C内出现浓厚的白烟并在容器内壁凝结,请设计一个实验方案鉴定该固体就是氯化铵:______.
(5)若从装置C和G处逸出的尾气中含有N2和少量Cl2,应如何处理?______.
参考答案:(1)浓盐酸和二氧化锰在加热条件下反应生成氯化锰、氯气和水,MnO2+4H++2C1-?△?.? Mn2++C12↑+2H2O.
故答案为:MnO2+4H++2C1-?△?.? Mn2++C12↑+2H2O.
(2)利用物质溶解时放出的热量促进氨水的挥发来制取氨气,且该物质和氨气不反应,氨气是碱性气体,所以溶解的物质必须是碱性物质,A.碱石灰、C.生石灰、E.烧碱都是碱性物质,且溶解于水时放出热量,D.五氧化二磷?
、B.浓硫酸虽然溶于水时放热,但是酸性物质.
故选A、C、D.
(3)氨气中混有水蒸气,氨气是碱性气体,要除去水蒸气只能用碱性物质,故选Ⅱ;制取的氯气中混有氯化氢气体和水蒸气,氯化氢极易溶于水,氯气也能溶于水,所以不能用水除去氯化氢气体;氯气和 水反应生成盐酸和次氯酸,食盐水中含有氯离子,能抑制氯气的溶解,所以要想除去氯气中的氯化氢E应选Ⅰ;水蒸气常用浓硫酸除去,故D选Ⅲ.
故答案为:Ⅱ、Ⅲ、Ⅰ.
(4)氯气和氨气在常温下混合就能发生反应生成氯化铵和氮气8NH3+3C12=6NH4C1+N2;
氯化铵中含有氯离子和铵根离子,氯离子用硝酸酸化的硝酸银溶液检验;氨气用紫色石蕊试纸检验;检验方法为:将固体在烧杯中溶解,用试管取少量溶液,然后滴加少量硝酸酸化的AgNO3溶液,有白色沉淀产生,证明有C1-;用试管取少量溶液,加入浓烧碱溶液,加热,再将湿润的红色石蕊试纸放在试管口,红色石蕊试纸变蓝证明有NH4+.
故答案为:8NH3+3C12=6NH4C1+N2;将固体在烧杯中溶解,用试管取少量溶液,然后滴加少量硝酸酸化的AgNO3溶液,有白色沉淀产生,证明有C1-;用试管取少量溶液,加入浓烧碱溶液,加热,再将湿润的红色石蕊试纸放在试管口,红色石蕊试纸变蓝证明有NH4+.
(5)氯气有毒,所以不能直接排空,但氯气能和水反应生成盐酸和次氯酸,盐酸和次氯酸都能和氢氧化钠反应生成盐,所以除去氯气应选用氢氧化钠溶液吸收,方法为:将导气管与G口连接,另一端插入盛有NaOH溶液的烧杯中.
故答案为:将导气管与G口连接,另一端插入盛有NaOH溶液的烧杯中.
本题解析:
本题难度:一般
2、选择题 实验室制Cl2的反应为4HCl(浓)+MnO2
MnCl2+Cl2↑+2H2O.下列说法错误的是( )
A.还原剂是HCl,氧化剂是MnO2
B.每生成1mol Cl2,转移电子的物质的量为2 mol
C.每消耗1mol MnO2,起还原剂作用的HCl消耗4mol
D.生成的Cl2中,除含有一些水蒸气外,还含有HCl杂质
参考答案:C
本题解析:
本题难度:一般
3、实验题 某化学兴趣小组的同学利用下图装置制取Cl2并完成下列反应的实验:2Cl2+C+2H2O 4HCl+CO2
4HCl+CO2

(1)A为氯气发生装置,写出反应的化学方程式__________________;
(2)要将C装置接入B和D之间,正确的接法是:a→____→ ___→d。
(3)实验开始先点燃A处的酒精灯,打开旋塞K,让Cl2充满整个装置,再点燃D处的酒精灯。Cl2通过C装置后进入D,D装置内盛有炭粉,发生氧化还原反应,生成CO2和HCl(g),装置C的作用是_____________;为了使C装置发挥更好的作用,可向烧杯中加入浓硫酸,加入浓硫酸的作用是______________
下列物质中可用于代替浓硫酸发挥应有作用的是________ (填字母)。
A.硝酸铵 B.生石灰 C.氢氧化钠 D.氯化钠
(4)反应开始后进入E处的气体有____________,观察到E处石蕊试液发生的变化是_______________;发生反应的化学方程式是_____________________
(5)D处反应完毕后,关闭旋塞K,移去酒精灯,由于余热的作用,A处仍有少量Cl2产生,此时B中的现象是______________,B的作用是________________。
(6)为证明生成物中含有CO2,甲同学设想将以上E装置中紫色石蕊试液改为澄清石灰水,并根据澄清石灰水是否变浑浊,可证明生成物中是否含有CO2,你认为合理吗?_______(填“合理”或“不合理”);
说明理由:__________________
参考答案:(1)MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(2)c;b
(3)提供D处所需的水蒸气;加入的浓硫酸溶于水能放出大量的热,有利于试管中的水变为水蒸气,从而提供足量的水蒸气供反应需要;BC
(4)Cl2和HCl;石蕊试液先变红色,后变无色;Cl2+H2O=HCl+HClO
(5)瓶中液面下降,长颈漏斗内液面上升;贮存少量Cl2,避免Cl2对环境的污染
(6)不合理;反应生成的HCl(气)和未反应的Cl2,都能与石灰水反应,影响CO2使澄清石灰水变浑浊的现象
本题解析:
本题难度:一般
4、实验题 某校化学兴趣小组用浓盐酸与二氧化锰加热反应来制取并收集氯气,装置如图所示:

(1)写出该反应的化学方程式__________________。
(2)上述反应中,还原剂是______,1 mol该还原剂被氧化时转移的电子的物质的量是____mol。
(3)实验开始前,某学生对装置进行了气密性检查。方法是:连接好装置后,用弹簧夹夹住____(填“A”或“B”)处橡胶管,向分液漏斗中加水并打开活塞,当加到一定量时,停止加水,静置观察,当观察到分液漏斗中____ 时,表明该装置不漏气。
(4)兴趣小组的某些同学准备在烧杯中加入下列溶液中的一种来吸收残余氯气,你认为错误的是____(填字母)。
A.氢氧化钠溶液 B.碳酸钠浓溶液 C.浓H2SO4
参考答案:(1)4HCl(浓)+MnO2 MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑
(2)HCl(或浓盐酸);1
(3)B;液面(水面)不下降
(4)C
本题解析:
本题难度:一般
5、填空题 请回答:(1)实验室制取氨气的化学方程式为______.
(2)某同学用镊子夹取湿润的红色石蕊试纸靠近收集氨气的试管口,可观察到试纸变蓝,该现象说明氨气溶于水,溶液呈______性.
(3)干燥氨气可选用的试剂是______(填序号).
①碱石灰?②浓硫酸
(4)围绕不活泼金属能否与硝酸反应,进行了如下实验探究:在两支试管中各放入一小块铜片,分别加入稀硝酸和浓硝酸,立即塞上带导管的胶塞,并将导管通入另一只盛有NaOH溶液的试管中.请回答:
①实验中观察到,其中一支试管中反应较缓慢,产生的一种气体是______(填化学式),产生该气体的化学方程式是______.
②另一支试管中反应剧烈,产生的一种红棕色气体是______(填化学式),产生该气体的化学方程式是______
(5)工业上由氨气合成硝酸这一过程涉及的化学方程式①______②______③______.
参考答案:(1)实验室制取氨气是利用氢氧化钙和氯化铵固体加热反应生成;反应的化学方程式为:2NH4Cl+Ca(OH)2?△?.?2NH3↑+2H2O+CaCl2,
故答案为:2NH4Cl+Ca(OH)2?△?.?2NH3↑+2H2O+CaCl2
(2)湿润的红色石蕊试纸靠近收集氨气的试管口,可观察到试纸变蓝,该现象说明氨气溶于水,氨气溶于水生成一水合氨,一水合氨电离出铵根离子和氢氧根离子,溶液呈碱性,
故答案为:碱性;
(3)氨气是碱性气体,用碱性干燥剂干燥,故答案为:①;
(4)依据稀硝酸和浓硝酸都和铜发生反应写出化学方程式;①实验中观察到,其中一支试管中反应较缓慢,产生的一种气体是一氧化氮,反应的化学方程式为:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,故答案为:NO;3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O;
②另一支试管中反应剧烈,产生的一种红棕色气体是二氧化氮,反应的化学方程式为:Cu+4HNO3=Cu(NO3)2+2NO2↑+2H2O,
故答案为:NO2;Cu+4HNO3=Cu(NO3)2+2NO2↑+2H2O;
(5)依据工业制备硝酸的原理分析判断写出化学方程式;过程为氨气的催化氧化生成一氧化氮,一氧化氮氧化为二氧化氮,二氧化氮溶于水生成硝酸和一氧化氮;反应的化学方程式为:4NH3+5O2催化剂.△4NO+6H2O,2NO+O2=2NO2,3NO2+H2O=2HNO3+NO,故答案为:4NH3+5O2催化剂.△4NO+6H2O;2NO+O2=2NO2;3NO2+H2O=2HNO3+NO.
本题解析:
本题难度:一般