1、选择题 下列文字表述与反应方程式对应且正确的是(?)
A.实验室制乙炔:CaC2+H2O →Ca(OH)2+C2H2↑
B.用醋酸除去水垢:CaCO3 + 2H+==Ca2+ + H2O + CO2↑
C .乙醇和钠反应:CH3CH2OH + Na? → CH3CH2ONa + H2↑
.乙醇和钠反应:CH3CH2OH + Na? → CH3CH2ONa + H2↑
D.实验室用液溴和苯在催化剂作用下制溴苯:
参考答案:B
本题解析:略
本题难度:简单
2、选择题 在复盐NH4Fe(SO4)2溶液中逐滴加入Ba(OH)2溶液,可能发生的反应的离子方程式是( )
A.Fe2++SO42-+Ba2++2OH-=BaSO4↓+Fe(OH)2↓
B.NH4++Fe3++2SO42-+2Ba2++4OH-=2BaSO4↓+Fe(OH)3↓+NH3?H2O
C.2Fe3++3SO42-+3Ba2++6OH-=3BaSO4↓+2Fe(OH)3↓
D.3NH4++Fe3++3SO42-+3Ba2++6OH-=3BaSO4↓+Fe(OH)3↓+3NH3?H2O
参考答案:NH4Fe(SO4)2可以写成(NH4)2SO4?Fe2(SO4)3的形式,向NH4Fe(SO4)2溶液中加入Ba(OH)2溶液时,OH-先和Fe3+反应,再和NH4+反应,所以当Ba(OH)2过量时选项B正确;当Ba(OH)2不足时选项C正确.又因为NH4Fe(SO4)2中Fe的化合价是+3价,因此选项A错误.
故选:B、C
本题解析:
本题难度:一般
3、选择题 己知Ba(AlO2)2能溶于水。右图表示的是向Al2(SO4)3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加入Ba(OH)2的物质的量x的关系。下列叙述正确的是
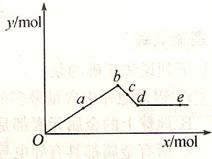
A.a-b时沉淀的物质的量:Al(OH)3比BaSO4多
B.c-d时溶液中离子的物质的量:AlO2-比Ba2+少
C.a-d时沉淀的物质的量:BaSO4可能小于Al(OH)3
D.d-e时溶液中离子的物质的量:Ba2+可能等于OH-
参考答案:D
本题解析:从0 b段表示SO42-恰好完全反应时发生反应的两种方程式为:2Al3++3SO42-+3Ba2++6OH-=3BaSO4↓+ 2Al(OH)3↓。在此段BaSO4比Al(OH)3物质的量多。在b
b段表示SO42-恰好完全反应时发生反应的两种方程式为:2Al3++3SO42-+3Ba2++6OH-=3BaSO4↓+ 2Al(OH)3↓。在此段BaSO4比Al(OH)3物质的量多。在b d若继续滴加Ba(OH)2溶液,发生反应:Al(OH)3+OH-= AlO2-+ 2H2O.当达到d点时该反应恰好完全发生。在此过程中AlO2-的物质的量为Ba2+的2倍。此时的溶液为Ba(AlO2)2溶液。此后再滴加,也不会发生任何反应。溶液为Ba(AlO2)2与Ba(OH)2的混合溶液。而在a-b时沉淀的物质的量:BaSO4大于Al(OH)3。b至d由于Al(OH)3溶解消耗,所以更是物质的量BaSO4大于Al(OH)3。由于在d-e时溶液为Ba(AlO2)2与Ba(OH)2的混合溶液,当二者的物质的量的比为1:1时,溶液中离子的物质的量:Ba2+就等于OH-。正确。因此正确选项为D。
d若继续滴加Ba(OH)2溶液,发生反应:Al(OH)3+OH-= AlO2-+ 2H2O.当达到d点时该反应恰好完全发生。在此过程中AlO2-的物质的量为Ba2+的2倍。此时的溶液为Ba(AlO2)2溶液。此后再滴加,也不会发生任何反应。溶液为Ba(AlO2)2与Ba(OH)2的混合溶液。而在a-b时沉淀的物质的量:BaSO4大于Al(OH)3。b至d由于Al(OH)3溶解消耗,所以更是物质的量BaSO4大于Al(OH)3。由于在d-e时溶液为Ba(AlO2)2与Ba(OH)2的混合溶液,当二者的物质的量的比为1:1时,溶液中离子的物质的量:Ba2+就等于OH-。正确。因此正确选项为D。
本题难度:一般
4、简答题 某核素ZAX的氯化物XCl21.10g配成溶液后,需用1mol?L-1的硝酸银溶液20mL才能把氯离子完全沉淀下来,试计算:
(1)X的质量数;
(2)若X的核内中子数为20,求37g?X1735Cl2中所含质子的物质的量.
参考答案:(1)硝酸银的物质的量为0.02L×1mol?L-1=0.02mol,即银离子的物质的量为0.02mol,
由Cl-+Ag+═AgCl↓可知,硝酸银溶液20mL能把氯离子完全沉淀下来,
则Cl-的物质的量为0.02mol,
XCl2的物质的量为0.01mol,
则XCl2的摩尔质量为1.10g0.01mol=110g/mol,
其相对分子质量为110,则X的质量数为110-35×2=40,
答:X的质量数为40;?
(2)X的质子数为40-20=20,Cl的质子数为17,
37g?X1735Cl2中所含质子的物质的量为37g110g/mol×(20+17×2)=18mol,
答:37g?X1735Cl2中所含质子的物质的量为18mol.
本题解析:
本题难度:一般
5、选择题 能正确表示下列化学反应的离子方程式的是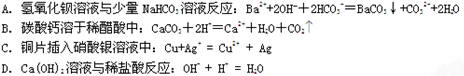
参考答案:D
本题解析:略
本题难度:一般