1、填空题 下列关于实验现象的描述,正确的是
① 由铜锌组成的原电池,电子是从锌经过导线流向铜
② 把铜片和锌片紧靠在一起浸入稀硫酸中,铜表面出现气泡
③ 把铜片插入三氯化铁溶液中,在铜片表面出现一层铁
④ 把锌片放入盛盐酸的试管中,加入几滴氯化铜溶液,产生气泡的速率加快
参考答案:①②④
本题解析:略
本题难度:简单
2、选择题 关于如图所示装置的叙述,正确的是( )
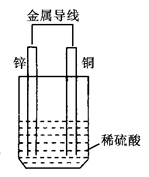
A.锌是正极,逐渐溶解
B.硫酸根物质的量不断减小
C.阳离子向正极移动
D.电子从铜片经导线流向锌片
参考答案:C
本题解析:在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应。锌比铜活泼,所以锌是负极,失去电子;铜是正极,溶液中的氢离子得到电子,所以正确的答案选C。
本题难度:一般
3、填空题 铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式 。
(2)若将(1)中的反应设计成原电池,请画出原电池的装置图,标出正、负极,并写出电极反应式。指出电解质溶液是__________,正极电极反应式为__________________。
(3)写出甲醇(CH3OH)—空气碱性燃料电池(KOH作为电解质溶液)的负极反应式:_______________________________。
参考答案:(1)2Fe3++Cu=2Fe2++Cu2+;(2分)
(2)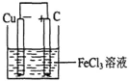 (2分) ;
(2分) ;
FeCl3(1分); 2Fe3++2e—=2Fe2+。(2分)
(3) CH3OH-6e-+8OH-=CO32-+6H2O (3分)
本题解析:(1)Fe3+有强氧化性,能把金属铜氧化成铜离子,自身被还原成 Fe2+,反应方程式为2Fe3++Cu=2Fe2++Cu2+,故答案为:2Fe3++Cu=2Fe2++Cu2+;
(2)设计成原电池时,负极上发生氧化反应,正极上发生还原反应,该电池反应中三价铁离子得电子发生还原反应,所以正极上的电极反应式为Fe3++e-=Fe2+(或2Fe3++2e-=2Fe2+),铜失电子发生氧化反应,所以负极上的电极反应式为Cu=2Cu2++2e-(或Cu-2e-=Cu2+);
电池反应中发生氧化反应的金属作负极,所以铜作负极,不如负极活泼的金属或导电的非金属作正极,可选石墨作正极,发生还原反应的电解质溶液作原电池的电解质溶液,所以该原电池图为 ,故答案为:
,故答案为: ;Cu-2e-=Cu2+;
;Cu-2e-=Cu2+;
Fe3++e-=Fe2+(或2Fe3++2e-=2Fe2+)。
(3)甲醇是负极,失去电子,电极式为CH3OH-6e-+8OH-=CO32-+6H2O。
考点:盐和亚铁盐的相互转变 电极反应和电池反应方程式.
点评:本题考查了原电池的工作原理及原电池的设计,难度较大,原电池的设计是学习的重点和难度。
本题难度:一般
4、选择题 某蓄电池放电、充电时的反应为Fe+Ni2O3+3H2O Fe(OH)2+2Ni(OH)2
Fe(OH)2+2Ni(OH)2
下列推断中正确的是( )?
①放电时,Fe为正极,Ni2O3为负极 ②充电时,阴极上的电极反应式是:Fe(OH)2+2e-=Fe+2OH- ③充电时,Ni(OH)2为阳极 ④该蓄电池的电极必须是浸在某种碱性电解质溶液中
A.①②③
B.①②④
C.①③④
D.②③④
参考答案:D
本题解析:根据元素化合价变化,放电时Fe为负极,Ni2O3为正极,①错;充电时,阴极发生还原反应,②对;充电时,Ni(OH)2中Ni元素的化合价升高,因此Ni(OH)2为阳极,③对;因Fe、Ni2O3、Fe(OH)2、Ni(OH)2均可以与酸反应,因此该蓄电池的电极必须浸在碱性电解质溶液中。
本题难度:一般
5、选择题 下列各个装置中能组成原电池的是
[? ]
A.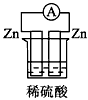
B.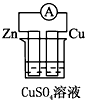
C.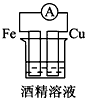
D.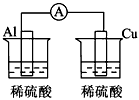
参考答案:D
本题解析:
本题难度:简单