|
高中化学必备知识点《原电池原理》高频试题巩固(2017年最新版)(八)
2018-03-17 07:23:22
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
1、选择题 乙醇燃料电池中采用磺酸类质子溶剂,电池总反应为:C2H5OH+3O2=2CO2+3H2O下列说法错误的是( )
A.电池工作时,质子向电池的正极迁移
B.电池工作时,电流由b极沿导线流向a极
C.a为负极,电极反应式是C2H5OH+3H2O+12e-=2CO2+12H+
D.b为正极,电极反应式是4H++O2+4e-=2H2O
| 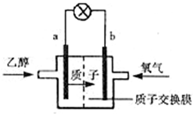
参考答案:A、该燃料电池放电时,带正电荷的微粒向正极移动,所以质子向正极移动,故A正确.
B、燃料电池中,投放燃料的电极是负极,投放氧化剂的电极是正极,所以该燃料电池放电时,电流从正极b沿导线流向负极a,故B正确.
C、燃料电池中,投放燃料的电极是负极,投放氧化剂的电极是正极,负极上燃料失去电子发生氧化反应,所以电极反应式为C2H5OH+3H2O-12e-=2CO2+12H+,故C错误.
D、燃料电池中,投放燃料的电极是负极,投放氧化剂的电极是正极,正极上氧气得电子和氢离子反应生成水,所以电极反应式为4H++O2+4e-=2H2O,故D正确.
故选C.
本题解析:
本题难度:简单
2、选择题 铜片、银片、Cu (NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U型管)构成一个原电池。以下有关该原电池的叙述正确的是
①实验过程中取出盐桥,原电池仍继续工作
②将铜片浸入AgNO3溶液中发生的化学反应与该原电池反应相同
③负极反应为:Ag+ + e- = Ag
④盐桥内的K+移向AgNO3溶液
A.②④
B.①②
C.②③
D.③④
参考答案:A
本题解析:将铜片插入硝酸铜溶液中、银片插入硝酸银溶液中,铜片与银片用导线连接,两烧杯之间用盐桥连接构成原电池。若取出盐桥,则形成断路,不能构成原电池,①错误;该电池总反应为Cu+2AgNO3=Cu(NO3)2+2Ag,与铜片浸入硝酸银溶液中发生的化学反应相同,②正确;负极为Cu,电极反应式为Cu-2e-=Cu2+、正极为Ag,电极反应式为Ag++e-=Ag,③错误;盐桥中阳离子向正极迁移、阴离子向负极迁移,④正确。
点评:原电池中负极失去电子,发生氧化反应;正极表面得到电子,发生还原反应。电子由负极经导线流向正极,原电池内部,阳离子向正极迁移、阴离子向负极迁移。
本题难度:一般
3、选择题 如图为氢氧燃料电池示意图,按此图的提示,下列叙述不正确的是(?)
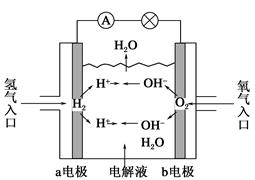
A.a电极是负极
B.b电极的电极反应为:4OH--4e-=2H2O+O2↑
C.氢氧燃料电池是一种具有应用前景的绿色电源
D.氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置
参考答案:B
本题解析:燃料电池是一种高效、环境友好的具有应用前景的绿色电源,不需要将还原剂和氧化剂全部储藏在内部的新型发电装置。在燃料电池中,燃料(H2)从负极充入,发生氧化反应,故A、C、D正确。在B中,O2在正极上发生还原反应,电极反应式为:O2+2H2O+4e-=4OH-,故B错误。
本题难度:一般
4、选择题 铜锌原电池(如图)工作时,下列叙述正确的是

[? ]
A.正极反应为:Zn - 2e- = Zn2+
B.电池反应为:Zn + Cu2+ = Zn2+ + Cu
C.Cu2+氧化性较强,作为负极
D.盐桥中的K+移向ZnSO4溶液
参考答案:B
本题解析:
本题难度:一般
5、填空题 高铁酸钠的化学式为Na2FeO4,按要求回答下列问题:
(1)高铁酸钠主要通过如下反应制取:
 ,则X的化学式为_____________。 ,则X的化学式为_____________。
(2)高铁酸钠是一种新型净水剂,在水中可以发生如下反应:
 。由此看来,高铁酸钠能够杀菌消毒是因为它具有________性,而能够除去水中悬浮物是因为__________。 。由此看来,高铁酸钠能够杀菌消毒是因为它具有________性,而能够除去水中悬浮物是因为__________。
(3)FeO42-在水溶液中的存在形态如图所示。向pH=8的这种溶液中加KOH溶液,发生反应的离子方程式为___________________。

(4)高铁电池是一种新型可充电电池,电解池为碱溶液,其反应式为
 则电池正极材料是_________,充电时电池正极________(填“得”“失”)电子,放电时电池的负极反应式为___________。 则电池正极材料是_________,充电时电池正极________(填“得”“失”)电子,放电时电池的负极反应式为___________。
参考答案:(1)NaCl
(2)氧化性;生成的Fe(OH)3,在水中形成胶体能吸附水中的悬浮杂质
(或 ) )
(3)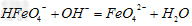
(4)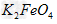 ;失; ;失;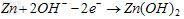
本题解析:
本题难度:一般
| 