1、选择题 为鉴别K2CO3和NaHCO3两种白色固体,有五位同学为鉴别它们,分别设计了下列五种不同的方法,其中不可行的是
①分别取样加入1mol/L的盐酸溶液,看有无气泡产生
②分别取样在试管中加热,将可能产生的气体通入澄清石灰水,观察有无白色浑浊
③分别取样配成溶液,滴加BaCl2溶液,观察有无白色浑浊
④分别配成溶液,用铂丝蘸取溶液在酒精灯火焰上灼烧,观察火焰的颜色
⑤分别取样配成溶液,滴加澄清石灰水,观察有无白色浑浊
A.①③⑤
B.②④
C.①⑤
D.③
参考答案:C
本题解析:两种盐都与盐酸反应生成CO2,所以选项①不能鉴别;碳酸氢钠受热易分解,生成CO2气体,所以选项②可以;碳酸钾能和氯化钡反应生成白色沉淀,而碳酸氢钠不能与氯化钡反应,因此选项③可以;钠和钾的焰色反应是不同的,选项④可以;两种盐都能和石灰水反应生成白色沉淀,所以选项⑤不能鉴别,答案选C。
本题难度:一般
2、选择题 已知X为第三周期元素的原子,该原子要达到8电子稳定结构,则需要的电子数小于其次外层和最内层的电子数之差,且等于最内层电子数的整数倍。下列说法正确的是(?)
A.X元素最高价氧化物对应的水化物一定是强酸
B.X元素的氢化物的化学式一定为H2X
C.X的单质一定是良好的半导体材料
D.X元素的氧化物一定能与烧碱反应
参考答案:D
本题解析:第三周期元素的次外层有8个电子,最内层有2个电子,二者之差为6。因为该原子达到8电子稳定结构需要的电子数小于6,则需要的电子数为2或4。若为2,则X为S;若为4,则X为Si,硅酸为弱酸,A错;硅的氢化物为SiH4,B错;S单质不能作半导体材料,C错;SO2、SO3和SiO2都能与烧碱反应,D正确。
本题难度:一般
3、填空题 下表为元素周期表的一部分:
?族
周期
| ?
| ?
| ?
|
1
| ①
| ?
| ?
| ?
| ?
| ?
| ?
| ?
|
2
| ?
| ?
| ?
| ?
| ?
| ②
| ?
| ?
|
3
| ③
| ?
| ?
| ④
| ?
| ⑤
| ⑥
| ?
|
?
Ⅰ.请参照元素①-⑥在表中的位置,用化学用语回答下列问题:
(1)写出元素②的离子结构示意图______________。
(2)②、③、⑤的离子半径由大到小的顺序为_________________________。
(3)元素④与⑥形成化合物的电子式是_________________________。
Ⅱ.由上述部分元素组成的物质间,在一定条件下,可以发生下图所示的变化,其中A是一种淡黄色固体。请回答:
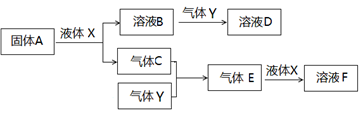
(4)写出固体A与液体X反应的离子方程式?。
(5)气体Y是一种大气污染物,直接排放会形成酸雨。可用溶液B吸收,当B与Y物质的量之比为1:1且恰好完全反应时,所得溶液D。已知溶液D显酸性,则D溶液中各种离子浓度由大到小的顺序为?。
(6)在500℃,101kPa时,气体C与气体Y反应生成0.2mol气体E时,放出akJ热量,写出该条件下反应的热化学方程式?。
(7)若气体C与Y在恒容绝热的条件下反应,下列说法能判断达到平衡状态的是?。
A.温度不变? B.气体总压强不变? C.混合气体的密度不变? D.混合气体的平均分子量不变
参考答案:Ⅰ.(1)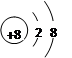 (1分)?(2)S2->O2-> Na+(2分)?(3)SiCl4
(1分)?(2)S2->O2-> Na+(2分)?(3)SiCl4
Ⅱ.(4)2Na2O2 +2H2O=4Na+ + 4OH― + O2↑(2分)
(5)c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>(OH-)(2分)
(6)2SO2 +O2 2SO3?△H=—10akJ/mol(2分) (7)ABD
2SO3?△H=—10akJ/mol(2分) (7)ABD
本题解析:(1)依据元素①-⑥在表中的位置可判断,分别为H、O、Na、Si、S、Cl,其中氧离子结构示意图为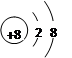 。
。
(2)核外电子层数越多微粒半径越大,在核外电子排布相同的条件下原子序数越小,微粒半径越大,则②、③、⑤的离子半径由大到小的顺序为S2->O2-> Na+。
(3)元素④与⑥形成化合物是四氯化硅,含有极性键的共价化合物,其电子式是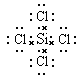 。
。
(4)A是一种淡黄色固体能与液体X反应生成气体C和溶液B,则A应该是过氧化钠,X是水,C应该是氧气,B是氢氧化钠,该反应的离子方程式为2Na2O2 +2H2O=4Na+ + 4OH― + O2↑。
(5)气体Y是一种大气污染物,直接排放会形成酸雨,因此Y是二氧化硫。氢氧化钠与二元氧化铝物质的量之比为1:1且恰好完全反应时生成亚硫酸氢钠。已知亚硫酸氢钠溶液显酸性,说明溶液中HSO3-电离程度大于HSO3-水解程度,因此溶液中各种离子浓度由大到小的顺序为c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>(OH-)。
(6)在500℃,101kPa时,气体C与气体Y反应生成0.2mol气体E时,放出akJ热量,则生成2molE即2mol三氧化硫时放出的热量是10akJ,则该条件下反应的热化学方程式为2SO2 +O2 2SO3?△H=—10akJ/mol。
2SO3?△H=—10akJ/mol。
(7)在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态,则A、体系是绝热的,温度不变可以说明达到平衡状态,A正确;B、正方应是体积减小的可逆反应,气体总压强不变可以说明反应达到平衡状态,B正确;C、密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,因此密度始终是不变的,则混合气体的密度不变不能说明反应达到平衡状态,C不正确;D、混合气的平均相对分子质量是混合气的质量和混合气的总的物质的量的比值,质量不变,但物质的量是变化的,混合气体的平均分子量不变可以说明达到平衡状态,D正确,答案选ABD。
本题难度:一般
4、填空题 A、B、C、D、E、F为短周期主族元素,原子序数依次增大,A原子中不含中子; C、D同周期;D的质子数 比B与C的最外层电子数之和少1,D的最外层电子数是次外层电子数的3倍;E与A同族,F与E同周期并且是该周期原子半径最小的金属元素。
⑴由A、B元素组成的是石油化工生产标志的物质的结构式是:?
⑵由A、D、E元素组成的物质与A、D、F元素组成的物质反应的离子方程式是:__________?
⑶B、C、D分别与A组成最简单化合物的稳定性从大到小顺序是:?
⑷由A、C、D元素组成盐含有的化学键有?(填化学键类型)该物质与A、D、E元素组成的物质反应的方程式是:
?
⑸E、F所在的金属元素最高价氧化物对应水化物的碱性由弱到强顺序是?(用化学式表示)
参考答案:⑴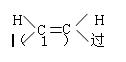 (1分)
(1分)
⑵ OH-+Al(OH)3==AlO2-+2H2O(2分)
⑶ H2O﹥ NH3﹥CH4(1分)
⑷ 离子键、共价键 (1分)
NH4NO3+NaOH==NaNO3+NH3·H2O(2分)
⑸?Al(OH)3﹤ Mg(OH)2 ﹤NaOH(1分)
本题解析:略
本题难度:一般
5、选择题 下列判断错误的是
A.沸点:NH3>PH3>AsH3
B.稳定性:HF>HCl>HBr>HI
C.酸性:HClO4>H2SO4>H3PO4
D.碱性:NaOH>Mg(OH)2>Al(OH)3
参考答案:A
本题解析:由于氨气分之间存在氢键,所以氨气的沸点在同主族元素的氢化物中沸点最高,其余的自上而下逐渐降低,所以选项A不正确,应该是NH3>AsH3>PH3。非金属性越强,相应氢化物的稳定性越强,最高价氧化物的水化物的酸性越强,B、C正确。同样金属性越强,最高价氧化物的水化物的碱性越强,D正确,答案选A。
本题难度:简单