|
高中化学知识点归纳《物质的组成》高频考点巩固(2017年模拟版)(十)
2018-03-17 07:28:09
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
1、填空题 I.用元素符号回答原子序数11-18的元素的有关问题:(填对应物质的化学式)
(1)最高价氧化物的水化物碱性最强的是?;其电子式为:?
(2)最高价氧化物的水化物呈两性的是?;
(3)能形成气态氢化物且最稳定的是?,其电子式为?.
II.化学是一门以实验为基础的自然科学,根据已有实验知识回答下列问题。
下列说法错误的是?。?
A.将Cl2通入紫色石蕊试液,溶液先变红后褪色
B.分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
C.配制1L0.5mol·L-1的NaCl溶液,需用托盘天秤称量29.25gNaCl固体
D.常温下,可以用铁质容器储运浓硝酸
| E.实验室可以用加热氯化铵的方法制取少量氨气
F.实验室保存硫酸亚铁溶液,需在试剂瓶内加入铁粉或铁钉,防止硫酸亚铁被氧化
G.除去KCl溶液中少量MgCl2:加入适量NaOH溶液,过滤
参考答案:I.(1)NaOH,
(2) Al(OH)3
(3)HCl,
II.C? E? G
本题解析:I.(1)原子序数11-18的元素中金属性最强的元素是Na,其最高价氧化物的水化物碱性最强,化学式为NaOH,电子式为 ; ;
(2)原子序数11-18的元素中Al的最高价氧化物的水化物呈两性,是Al(OH)3
(3)原子序数11-18的元素中Cl元素的非金属性最强,气态氢化物最稳定,化学式为HCl,电子式为 ; ;
II.A、氯气溶于水显酸性,石蕊试液变红,同时有次氯酸生成,所以又褪色,正确;B、分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出,正确;C、托盘天秤称量固体时只能精确到0.1g,错误;D、常温下,铁与浓硫酸发生钝化,反应停止,正确;E、氯化铵分解产生氨气和氯化氢气体,遇冷又结合成氯化铵,得不到氨气,错误;F、硫酸亚铁空气中被氧化为硫酸铁,所以需在试剂瓶内加入铁粉或铁钉,防止硫酸亚铁被氧化,正确;G、除去KCl溶液中少量MgCl2:加入适量NaOH溶液,除去了镁离子,同时又增加了钠离子,错误,答案选C、E、G。
本题难度:一般
2、选择题 核外电子层结构相同的一组微粒是?
A.Mg2+、Al3+、Cl-、Ne
B.Na+、F-、S2-、Ar
C.K+、Ca2+、S2-、Ar
D.Mg2+、Na+、Cl-、S2-
参考答案:C
本题解析:A.Mg2+、Al3+跟Ne电子层结构相同,Cl-跟Ar电子层结构相同;
B.Na+、F-跟Ne电子层结构相同,S2-跟Ar电子层结构相同;
D.Mg2+、Na+跟Ne电子层结构相同,而Cl-、S2-又跟Ar电子层结构相同;只有K+、Ca2+、S2-跟Ar的电子层结构相同。
本题难度:一般
3、填空题 A、B、C、D、E为原子序数依次增大的短周期元素,其中A原子中无中子,A与D同主族。B元素的氢化物水溶液能使红色石蕊试纸变蓝,C与E同主族,D与E同周期,E原子的最外层电子数等于两个内层电子数之差。回答下列问题:
(1)写出D元素的名称: ? ;比较原子半径B ? C(填“>”或“<”);
(2)由A、C、D元素形成的化合物中含有的化学键是 ? ;
(3)化合物A2C的电子式为 ? ;
(4)物质M由B元素的氢化物和最高价氧化物的水化物反应得到,则M属于 ? 晶体(填原子、分子或离子);
(5)由A、C形成的化合物和C、E形成的化合物发生反应只生成强酸,其化学方程式为 ? 。
参考答案:(1)钠(1分);>(1分)(2)离子键和共价键(1分)(3)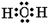 (1分) (1分)
(4)离子(1分) (5)H2O2+SO2=H2SO4 或H2O+SO3=H2SO4(2分)
本题解析:根据元素的结构、位置及有关性质可知A、B、C、D、E分别是H、N、O、Na、S。
(1)同周期自左向右原子半径直接减小,所以氮原子半径大于氧原子的。
(2)A、C、D元素形成的化合物是氢氧化钠,含有离子键和共价键。
(3)化合物A2C是H2O,含有极性键,电子式为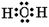 。 。
(4)氨气和硝酸反应生成硝酸铵,含有离子键,是离子化合物。
(5)A、C形成的化合物和C、E形成的化合物分别可以是H2O2和SO2、H2O和三氧化硫,所以方程式为H2O2+SO2=H2SO4 或H2O+SO3=H2SO4。
本题难度:一般
4、选择题 下列各组物质全都属于盐的一组是
A.CaCO3、KOH、Cu(NO3)2
B.BaSO4、Ca(OH)2、P2O5
C.Na2SO4、AgCl、H2SO4
D.NH4Cl、K2CO3、AgNO3
参考答案:D
本题解析:A项中KOH是碱;B项中Cu(OH)2是碱,P2O5是氧化物;C项中H2SO4是酸.
本题难度:简单
5、填空题 A、B、C、D均为短周期元素,原子序数依次增大。已知:
①A与D同主族,A形成的氢化物分子M与D形成的氢化物分子N都含有18个电子;
②一定条件下,A、D分别和B形成的化合物X和Y具有相同的摩尔质量,且焰色反应均呈黄色;
③A和C形成的化合物Z可形成原子晶体。
请回答下列问题:
(1)X的电子式为_____________;Z的化学式为______________。
(2)A、B、C、D四种元素的原子半径按由小到大排列的顺序为:? _______________________________________________(用元素符号表示)。
(3)化合物Y的水溶液pH>7,用离子方程式说明原因:?。
(4)在M的溶液中通入N,可发生反应生成D的单质和A的另一种氢化物,试写出化学方程式____________________________________________________。
参考答案:(1) ;SiO2 ;SiO2
(2)O<S<Si<Na
(3)S2- + H2O HS-+ OH- HS-+ OH-
(4)H2O2 + H2S=S↓+ 2H2O
本题解析:近年来高考理综化学中的元素推断题有与元素化合物知识结合推断的趋势。按照这种命题趋势命制,以达到高考要求的水平。
根据①,含18个电子的氢化物分子最容易想到的是第三周期的气态氢化物,而与之同主族的18电子氢化物分子就只有H2O2和H2S了,所以A是O,D是S,则M、N分别是H2O2和H2S;根据②知B是Na,类似H2O2和H2S,X、Y分别是Na2O2和Na2S;根据③知C为Si,Z为SiO2。
本题难度:一般
|