1、选择题 下列反应的离子方程式正确的是
A.饱和FeCl3溶液滴入沸水中:Fe3+ + 3H2O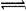 Fe(OH)3↓+ 3H+
Fe(OH)3↓+ 3H+
B.硫酸氢钠溶液中加入氢氧化钡溶液至溶液pH=7:Ba2+ + SO42-= BaSO4↓
C.氯化铝溶液中加入过量的氨水:Al3+ + 4OH-= AlO2-+ 2H2O
D.氯化亚铁溶液中滴入溴水:2Fe2+ + Br2 = 2Fe3+ +2Br-
参考答案:D
本题解析:
正确答案:D
A.不正确,饱和FeCl3溶液滴入沸水中:Fe3+ + 3H2O? Fe(OH)3(胶体)+ 3H+
Fe(OH)3(胶体)+ 3H+
B.不正确,硫酸氢钠溶液中加入氢氧化钡溶液至溶液pH=7:2H++2OH―+Ba2+ + SO42-= BaSO4↓+2H2O
C.不正确,氯化铝溶液中加入过量的氨水:Al3+ +3NH3·H2O=Al(OH)3+3NH4+
D.正确,氯化亚铁溶液中滴入溴水:2Fe2+ + Br2 = 2Fe3+ +2Br-,溴具有强氧化性。
本题难度:一般
2、选择题 对四种无色溶液进行离子检验,实验结果如下,其中没有错误的是( )
A.Cu2+、Na+、SO42-、Cl-
B.K+、Na+、MnO4-、NO3-
C.OH-、HCO3-、Ca2+、Na+
D.Ba2+、Na+、OH-、NO3-
参考答案:A、Cu2+离子有颜色,不符合题中无色要求,不能大量存在,故A错误;
B、MnO4-离子有颜色,不符合题中无色要求,不能大量存在,故B错误;
C、HCO3-离子与OH-离子反应OH-+HCO3-=CO32-+H2O,生成CO32-离子进而生成碳酸钙沉淀而不能大量共存,故C错误;
D、该项离子无色,符合题意,且离子间不发生任何反应,能大量共存,故D正确.
故选D.
本题解析:
本题难度:一般
3、计算题 将Cu与CuO的混合物20.8g加入到50mL 18.4mol/L浓H2SO4中,加热充分反应至固体物质完全溶解,冷却后将混合液稀释至1000 mL,测得c(Cu2+)="0.3" mol/L。试计算:
(1)反应过程中放出的气体在标准状况下的体积(不考虑气体在溶液中的溶解)。
(2)溶液稀释后,c(H+)是多少?
参考答案:(6分) (1)V(SO2)= 4.48L?(3分)(2)c(H +)=0.84mol/L?(3分)
本题解析:(1)测得c(Cu2+)="0.3" mol/L
则溶液中硫酸铜的物质的量是0.3mol/L×1L=0.3mol
其中铜离子的质量是0.3mol×64g/mol=19.2g
则原固体混合物中氧元素的质量是20.8g-19.2g=1.6g
物质的量是1.6g÷16g/mol=0.1mol
所以氧化铜的物质的量是0.1mol
质量是8g
则铜的质量是20.8g-8g=12.8g
物质的量是12.8g÷64g/mol=0.2mol
所以根据反应的化学方程式可知
Cu+2H2SO4(浓)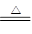 CuSO4+2H2O+SO2↑
CuSO4+2H2O+SO2↑
生成的SO2是0.2mol
标准状况下是0.2mol×22.4L/mol=4.48L
(2)氧化铜和铜消耗的硫酸的物质的量分别是0.1mol和0.4mol
则剩余硫酸的物质的量是0.05L×18.4mol/L-0.5mol=0.42mol
所以氢离子的物质的量是0.84mol
氢离子的浓度是0.84mol÷1L=0.84mol/l
点评:该题是中等难度的试题,试题综合性强,贴近高考。试题注重基础,侧重能力的培养和训练。有利于培养学生的逻辑推理能力,提高学生分析问题、解决问题的能力。该题的关键是利用好守恒法在计算中的应用,常用的守恒法包括质量守恒定律、电子得失守恒、电荷守恒以及原子守恒。
本题难度:一般
4、选择题 常温下,某溶液中由水电离产生的c(H+)与c(OH-)满足c(H+)-c(OH-)=10-24,则下列各离子组在该溶液中一定可以大量共存的是( )
A.K+Na+C6H5O-Cl-
B.Na+Cl-SO42- S2O32-
C.K+C2O42- MnO4- SO42-
D.Ba2+Na+Cl-NO3-
参考答案:溶液中由水电离产生的c(H+)与c(OH-)相等,由c(H+)?c(OH-)=10-24,则由水电离生成的c(H+)=c(OH-)=10-12,即水的电离受到抑制,溶液可能为酸或碱溶液,
A.酸溶液中,氢离子与C6H5O-结合生成弱酸苯酚,则不能共存,故A不选;
B.酸溶液中,氢离子与S2O32-结合生成硫、二氧化硫,则不能共存,故B不选;
C.酸溶液中,C2O42-、MnO4-发生氧化还原反应,则不能共存,故C不选;
D.无论酸或碱溶液,该组离子之间不反应,则能大量共存,故D正确;
故选D.
本题解析:
本题难度:一般
5、选择题 下列叙述正确的是?
A.c(NH4+)相等的(NH4)2SO4溶液、(NH4)2Fe(SO4)2溶液和NH4Cl溶液中,
溶质浓度大小关系是:c[(NH4)2Fe(SO4)2] < c[(NH4)2SO4] < c(NH4Cl)
B.向AgCl悬浊液中滴入KI溶液,有AgI沉淀生成,说明AgCl的溶解度小于AgI
的溶解度
C.0.2 mol?L-1盐酸与等体积0.05 mol?L-1Ba(OH)2溶液混合后,溶液的pH=1
D.0.2 mol?L-1的NaHCO3溶液中c(H+)+c(H2CO3)=2c(CO32-)+c(OH-)
参考答案:A
本题解析:A、(NH4)2Fe(SO4)2溶液,铵根离子和亚铁离子水解相互抑制,且电离出两个铵根,故浓度最小。
B、沉淀始终朝着溶解度小的方向进行;
C、中和后,c(H+)=0.05mol/L;
D、电荷守恒:c(H+)+c(Na+)=2c(CO32-)+c(OH-)+ c(HCO3-)
物料守恒:c(Na+)=c(CO32-)+c(H2CO3)+ c(HCO3-);二者相减
c(H+)+c(H2CO3)=c(CO32-)+c(OH-)
本题难度:简单