1、选择题 将一定量的氨基甲酸铵固体置于某容积恒定的真空容器中,发生
反应:H2NCOONH4(s)  2NH3(g)+CO2(g),在不同温度下,该反应达平衡状态时的部分数据如表所示。下列说法正确的是(?)
2NH3(g)+CO2(g),在不同温度下,该反应达平衡状态时的部分数据如表所示。下列说法正确的是(?)
温度
| 平衡浓度(mol·L-1)
|
?
| c(NH3)
| c(CO2)
|
T1
| 0.1
| ?
|
T2
| ?
| 0.1
|
?
A.若T2>T1,则该反应的ΔH<0
B.向容器中充入N2,H2NCOONH4质量增加
C.NH3体积分数不变时,说明该反应达到平衡
D.T1、T2时,转化的H2NCOONH4的物质的量Δn(T2)=2Δn(T1)
参考答案:D
本题解析:无论反应是否达到平衡状态,NH3的体积分数都是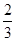 ,故C错误。T2时c(NH3)、c(CO2)都是T1时的2倍,容器的容积又恒定不变,所以T2时转化的H2NCOONH4是T1时的2倍,D正确。
,故C错误。T2时c(NH3)、c(CO2)都是T1时的2倍,容器的容积又恒定不变,所以T2时转化的H2NCOONH4是T1时的2倍,D正确。
本题难度:一般
2、选择题 有两个学生在条件完全相同的情况下测定可逆反应 A2(g)?+3B2(g) C2的化学反应速率,甲测得v(A2)= 0.5?mol/(L
C2的化学反应速率,甲测得v(A2)= 0.5?mol/(L min),乙测得v(B2)=1.5?mol/(L
min),乙测得v(B2)=1.5?mol/(L min),则这两个学生的测定结果
min),则这两个学生的测定结果
[? ]
A.都正确?
B.都错误
C.甲对乙错?
D.都对或都错
参考答案:D
本题解析:
本题难度:简单
3、填空题 在一个容积固定的反应器中,有一可左右滑动的密封隔板,左、右两侧分别进行如下可逆反应:2SO2(g)+O2(g) 2SO3(g);
2SO3(g);
3Fe(s)+4H2O(g)  Fe3O4(g)+4H2(g)。左侧中加入SO2、O2、SO3的物质的量分别为x mol、3.25mol、1mol;右侧中加入9 mol的水蒸气和适量的铁粉(忽略铁粉对容器体积的影响)。
Fe3O4(g)+4H2(g)。左侧中加入SO2、O2、SO3的物质的量分别为x mol、3.25mol、1mol;右侧中加入9 mol的水蒸气和适量的铁粉(忽略铁粉对容器体积的影响)。
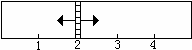
当x在一定范围内变化时,均可以通过调节反应器的温度,使两侧反应都达到平衡,并且隔板恰好处于反应器位置2处。请填写以下空白:
(1)若x=1.5,则左侧反应在起始时向__________(填“正反应”或“逆反应”)方向进行。欲使反应维持向该方向进行,则x的取值范围是________________。
(2)若x=2,则左侧反应在起始时向__________(填“正反应”或“逆反应”)方向进行,平衡时混合气中SO2所占的体积分数为_________。
参考答案:(1)逆反应? 1.25<x<1.75?(2)正反应 ?25%
本题解析:(1)这两个平衡体系的特点是:第一个反应前后气体的总物质的量发生变化,第二个保持不变,故右边永远是9mol气体,同在一个容器中,同温同压,故气体的物质的量之比等于体积之比。故平衡时,左边为6mol气体;当x=1.5时,左边现在总的物质的量为5.75mol<6mol,故向逆反应方向进行;若保持该方向,1.25<x<1.75;
(2)根据上述,反应向正反应方向进行了

平衡总物质的量为6mol,即 2-2y+3.25-y +1+2y= 6mol,解之,得y =0.25mol,2-2y? =1.5,二氧化硫的体积分数="1.5/6=25%" ;
点评:化学平衡是历年高考重中之重,考生一定要系统备考此知识点。难度较大。
本题难度:困难
4、选择题 有一容积固定的密闭反应器,中间有一个可自由移动的导热的隔板将容器分成甲、乙两部分,分别发生下列两个可逆反应:
甲:a(g)+b(g)  2c(g)? ΔH1<0、?乙: x(g)+3y(g)
2c(g)? ΔH1<0、?乙: x(g)+3y(g)  2z(g)? ΔH2>0
2z(g)? ΔH2>0
起初甲、乙均达到反应平衡后隔板位于正中间,然后进行相关操作后,下列叙述错误的是( )
A.绝热下向甲中通入惰性气体,c的物质的量不变
B.绝热下向乙中通入z气体,反应器中温度升高
C.恒温下向甲中通入惰性气体,甲中平衡不移动,乙中X、Y的转化率增大
D.恒温下向乙中通入z气体,y的物质的量浓度增大
参考答案:A
本题解析:A、绝热下向甲中通入惰性气体,隔板向右移动,乙中平衡正向移动,吸收热量,中间隔板是导热的,导致甲中温度降低,平衡正向移动,c的物质的量增大,错误;B、绝热下向乙中通入z气体,平衡向放热的逆向移动,反应器中温度升高,正确;C、恒温下向甲中通入惰性气体,甲中平衡不移动,乙中平衡因压缩而正向移动,X、Y的转化率增大,正确;D、恒温下向乙中通入z气体,平衡逆向移动,y的物质的量浓度增大,正确。
本题难度:一般
5、选择题 在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质
| X
| Y
| Z
|
初始浓度/mol·L-1
| 0.1
| 0.2
| 0
|
平衡浓度/mol·L-1
| 0.05
| 0.05
| 0.1
|
下列说法错误的是
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X+3Y 2Z,其平衡常数为1600
2Z,其平衡常数为1600
C.增大压强使平衡向生成Z的方向移动,平衡常数增大
D.改变温度可以改变此反应的平衡常数
参考答案:C
本题解析:达平衡时X的转化率为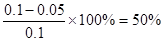 ,A正确;X的浓度变化量为:0.05 mol·L-1,Y的浓度变化量为:0.15 mol·L-1,Z的浓度变化量为:0.1 mol·L-1,三者浓度变化量之比=1:3:2,反应可表示为X+3Y?2Z,平衡常数
,A正确;X的浓度变化量为:0.05 mol·L-1,Y的浓度变化量为:0.15 mol·L-1,Z的浓度变化量为:0.1 mol·L-1,三者浓度变化量之比=1:3:2,反应可表示为X+3Y?2Z,平衡常数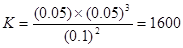 ,B正确;增大压强使平衡向生成Z的方向移动,由于温度不变,所以平衡常数不变,C错;平衡常数受温度的变化而变化,D正确。
,B正确;增大压强使平衡向生成Z的方向移动,由于温度不变,所以平衡常数不变,C错;平衡常数受温度的变化而变化,D正确。
本题难度:一般