1、实验题 50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1NaOH溶液在图示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
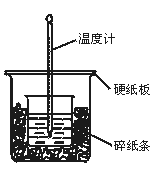
(1)从实验装置上看,图中尚缺少的一种玻璃用品是 。
(2)烧杯间填满碎纸条的作用是 。
(3)大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大”“偏小”“无影响”)。
(4)实验中改用60 mL 0.50 mol·L-1盐酸跟50 mL 0.55 mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等”“不相等”),所求中和热 (填“相等”“不相等”),简述理由: 。
参考答案:(1)环形玻璃搅拌棒(2)减少实验过程中的热量损失(3)减小
(4) 不等 相等 因为中和热是指酸和碱发生中和反应生成1molH2O所放出的热量,
与酸碱的用量无关
本题解析:中和热的测定过程中使用的酸和碱的量不同,反应放出的热量不同,但是中和热是指生成1mol水时放出的热量,所以中和热相同。
考点:中和热的测定。
本题难度:一般
2、选择题 下列化合物中,含有极性共价键的是( )
A.H2O
B.Cl2
C.NaCl
D.Na2O
参考答案:A
本题解析:一般活泼的金属和活泼的非金属容易形成离子键,非金属元素的原子间容易形成共价键,如果是同一种非金属原子之间形成共价键,则是非极性键。不同种非金属原子之间形成的是极性键。据此可知选项A中只有极性键,B中只有非极性键,C、D中只有离子键,答案选A。
点评:该题是高考中的常见考点,属于基础性试题的考查,试题基础性强,侧重对学生基础知识的训练,主要是考查学生灵活运用化学键知识解决实际问题的能力。该题的关键是明确离子键、共价键的含义和判断依据,然后结合题意灵活运用即可。
本题难度:简单
3、选择题 下列叙述与对应图式正确的是
| ①
| ②
| ③
| ④
| ⑤
| ⑥
| ⑦
| ⑧
|
原子半径
| 0.74
| 1.60
| 1.52
| 1.10
| 0.99
| 1.86
| 0.75
| 0.82
|
主要化合价
| -2
| +2
| +1
| +5、-3
| +7、-1
| +1
| +5、-3
| +3
|

A.由下列短周期元素性质的数据推断元素③最高价氧化物对应的水化物碱性最强
B.图甲装置中,待镀铁制品应与电源负极相连
C.图乙表示H2与O2发生反应过程中的能量变化,则H2的燃烧热的热化学方程式为:2H2(g)+O2(g)=2H2O(g) △H=" —" 483.6 kJ/mol
D.图丙表示某一放热反应,若使用催化剂E1、E2、△H都会发生改变
参考答案:B
本题解析:根据表格提供的数据可知:①是O;②是Mg;③是Li;④是P;⑤是F;⑥是Na;⑦是N;⑧是Al。A.由于在上述元素中金属性最强的是Na,所以由下列短周期元素性质的数据推断元素⑥最高价氧化物对应的水化物碱性最强,错误;B.在图甲电镀装置中,待镀铁制品应与电源负极相连,镀层金属与电源的正极连接,作阳极,正确;C.图乙表示H2与O2发生反应过程中的能量变化,由于燃烧热是1mol的可燃物完全燃烧产生稳定的氧化物时所放出的热量,H2O的稳定的氧化性是液态水,则H2的燃烧热的热化学方程式中的△H<— 241.8 kJ/mol ,错误;D.图丙表示某一放热反应,若使用催化剂E1、E2都会发生改变,但是△H不变,错误。
考点:考查元素的性质与原子结构的关系、电镀、热化学方程式的书写及反应热与焓变和活化能的关系的知识。
本题难度:一般
4、填空题 (9分)“西气东输”是西部开发的重点工程,这里的“气”是指天然气,其主要成分是甲烷。水煤气中主要成分是CO和H2,二者的体积比为l :l。已知:在120℃和一个大气压下,H-H键能为436 kJ/mol,O=O键能为496 kJ/mol,H-O键能为463 kJ/mol ;1 mol CO气体完全燃烧生成CO2气体放出283 kJ热量;l mol CH4气体完全燃烧生成CO2气体和气态水放出802 kJ热量。
(1)写出120℃和一个大气压下,H2完全燃烧生成气态水的热化学方程式 ;
(2)相同条件下,若l mol CH4气体完全燃烧生成CO2气体和液态水,放出的热量 802 kJ;(选填“>”、“=”、“<”)
(3)忽略水煤气中其他成分,燃烧等体积的CH4和水煤气,所得热量之比约为 ;
(4)请结合以上计算结果,叙述相比于水煤气,天然气作为燃料的两个优点:
。
参考答案:(9分)
(1)2H2(g)+O2(g) = 2H2O(g) △H= —484kJ·mol-1(3分,也可分数表示)
(2)>;(2分)
(3) 3.06(3.1)∶1 (2分) (列式正确均给分如:802:(283+242)/2)
(4)燃烧等体积的气体产生的热量多;产生等量的热量CO2排放量少;CO有毒;以天然气代替水煤气有利于保护环境。(2分,答对2点即可,只答1点给1分,合理答案均给分)
本题解析:略
本题难度:简单
5、选择题 根据键能数据估算CH4(g)+4F2(g) =CF4+4HF(g)的反应热ΔH为

[? ]
A.-1940 kJ · mol-1
B.1940 kJ · mol-1
C.-485 kJ · mol-1
D.485 kJ · mol-1
参考答案:A
本题解析:
本题难度:一般