1、选择题 一定温度下,向体积为2L的恒容密闭容器中充入1mol PCl5(g),发生反应:PCl5(g) PCl3(g)+Cl2(g)?△H=+Q? KJ/mol维持容器温度不变,测得容器内压强随反应时间的变化如图所示。下列说法正确的是(?)
PCl3(g)+Cl2(g)?△H=+Q? KJ/mol维持容器温度不变,测得容器内压强随反应时间的变化如图所示。下列说法正确的是(?)
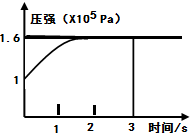
A.3s内的平均速率为:V(PCl3)=0.1mol·L-1·min-1
B.达到平衡时放出0.6QKJ热量
C.其他条件不变,再向容器中充入1molPCl5(g),则达新平衡 时,C(PCl5)>0.4mol·L-1
D.其他条件不变,增大PCl5的浓度,平衡常数减小
参考答案:C
本题解析: A.恒温、恒容的密闭容器中,气体的物质的量之比等于压强之比,则平衡时混合气体的物质的量为1.6mol,气体的物质的量增大(1.6-1)mol=0.6mol,设生成PCl3的物质的量为x,
PCl5(g)?PCl3(g)+Cl2(g) 气体增加的物质的量
1mol? 1mol
x? 0.6mol
x=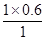 mol=0.6mol,
mol=0.6mol,
V(PCl3)==0.1mol/(L.s),时间单位是S不是min,错误;B.该反应是吸热反应不是放热反应,当气体增加1mol时吸收的热量是QKJ,则气体增加0.6mol时吸收的热量是0.6QKJ,错误;? C.平衡体系中再加入1mol的PCl5,重新到达平衡状态,可以等效为开始加入2mol的PCl5,体积增大为原来的2倍,达平衡(该平衡与原平衡等效)后再将体积压缩到原来大小,与原平衡相比,压强增大,平衡向逆反应方向移动,则平衡浓度大于原来的两倍,正确;D.温度不变,平衡常数不变,错误.
本题难度:一般
2、填空题 T℃时,A气体与B气体反应生成C气体,反应过程中A、 B、C浓度变化如图(I)所示,若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(II)所示。
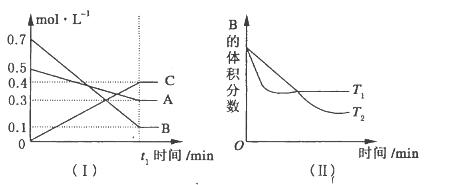
根据以上条件,回答下列问题:
(1)A与B反应生成C的化学方程式为_________________________________________,
正反应为_________________________(填“放热”或“吸热”)反应。
(2)t1min后,改变下列某—条件,能使平衡向逆反应方向移动的有___________(填字母编号)。
A.保持其他条件不变,增大压强
B.保持容器总体积不变,通入少量稀有气体
C.保持其他条件不变,升高温度
参考答案:(共6分)(1)A(g)+3B(g) 2C(g)? (2分)?放热?(2分)
2C(g)? (2分)?放热?(2分)
(2)C? (2分)
本题解析:(1)由图(Ⅰ)知在一定时间内,A、B、C浓度的变化量之比等于1:3:2,所以A与B反应生成C的化学方程式为A(g)+3B(g) 2C(g),由图(Ⅱ)结合“先拐先平”的规律知T1>T2,说明温度升高,B的体积分数增大,平衡逆向移动,正向为放热反应;
2C(g),由图(Ⅱ)结合“先拐先平”的规律知T1>T2,说明温度升高,B的体积分数增大,平衡逆向移动,正向为放热反应;
(2)A、增大压强平衡正向移动,错误;B、容器总体积不变,通入少量稀有气体,各物质的浓度不变,平衡不移动,错误;C、升温,平衡逆向移动,正确,答案选C。
本题难度:一般
3、填空题 有甲、乙两个容积均为1 L的密闭容器,在控制两容器的温度相同且恒定的情况下进行反应:2A(g)+B(g)  xC(g),①向甲中通入4 mol A、2 mol
xC(g),①向甲中通入4 mol A、2 mol  B,达平衡时测得其中C的体积分数为40%;②向乙中通入1 mol A、0.5 mol B和3 mol C,平衡时测得C的体积分数为W%。试回答:
B,达平衡时测得其中C的体积分数为40%;②向乙中通入1 mol A、0.5 mol B和3 mol C,平衡时测得C的体积分数为W%。试回答:
(1)若乙W%=40%,且建立平衡的过程中乙压强有变化,则x=?。
(2)若乙W%=40%,且平衡时甲、乙压强不同,则乙平衡时c(A) =?。
(3)若x=4,则W%?40% (填“大于”、“小于”或“等于”)。
参考答案:
本题解析:略
本题难度:一般
4、填空题 某温度时,在一个容积为2L的密闭容器中,X、Y、Z,三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
(1)该反应的化学方程式为______;
(2)反应开始至2min,用气体Z表示的反应 速率为______;
(3)若X、Y、Z均为气体,反应达到平衡时:
①压强是开始时的______倍;
②若此时将容器的体积缩小为原来的0.5倍,达到平衡时,容器内温度将降低(容器不与外界进行热交换),则该反应的正反应为______反应(填“放热”或“吸热”).
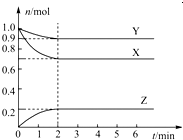
参考答案:(1)△n(X)=0.3mol;△n(Y)=0.1mol;△n(Z)=0.2mol,所以三者计量数之比为3:1:2,故答案为:3X+Y?2Z;
(2)v(Z)=△c△t=△nV?△t=0.2mol2L?2min=0.05mol?L-1?min-1,故答案为:0.05mol?L-1?min-1;
(3)①根据图象中可知,开始时气体总物质的量为:2mol;平衡后气体总物质的量为:0.9mol+0.7mol+0.2mol=1.8mol;P平衡P起始=n平衡n起始=1.8mol2mol=0.9,
故答案为:0.9;
②压强变大,平衡向右移动,而体系温度降低,说明正反应方向为吸热,故答案为:吸热.
本题解析:
本题难度:一般
5、选择题 在相同条件下(T=500k),相同体积甲、乙两容器,甲充入1gSO2、1gO2,乙充入2gSO2、2gO2.下列叙述错误的是(?)
A.化学反应速率乙>甲
B.平衡后O2浓度乙>甲
C.SO2转化率乙>甲
D.平衡后SO2的体积分数乙>甲
参考答案:D
本题解析:
A正确,化学反应速率与浓度大小有关,相同条件下,反应物的浓度越大,反应速率越快;B正确,由于乙的投量更多,即平衡后O2浓度乙>甲;C正确,乙的反应相当于两个甲叠加,即相当于增大压强,平衡向气体体积减少的方向移动,所以SO2转化率乙>甲;D错,由于乙的反应物转化率更高,所以平衡后SO2的体积分数甲>乙;
本题难度:一般