1、选择题 在一定温度下,可逆反应A(气)+3B(气)  2C(气)达到平衡的标志是(? )?
2C(气)达到平衡的标志是(? )?
A.A、B、C的分子数比为132?
B.A、B、C的浓度相等
C.C生成的速率与C分解的速率相等?
D.单位时间生成n mol A,同时生成3n mol B
参考答案:C
本题解析:对于一个可逆反应,达到化学平衡的特征为1.正反应速率等于逆反应速率。2.各物质的浓度保持不变。A选项,各物质在达到化学平衡时不一定是按化学计量数的比例存在。所以A选项是错误的。B选项是各物质的浓度保持不变,不是相等,所以B 选项是错误的。D应该为单位时间生成n mol A,同时消耗3n mol B
本题难度:一般
2、选择题 氯化硫酰(SO2Cl2)是一种氯化剂,遇水可生成硫酸和氯化氢。干燥的二氧化硫和氯气在活性炭催化剂存在下反应生成氯化硫酰:SO2(g)+Cl2(g) SO2Cl2(l),在某密闭容器中加入16. 20g氯化硫酰,达到平衡时容器中含SO2 7.616 g。反应后将平衡混合物溶于足量的BaCl2溶液中,则最终生成沉淀的质量
SO2Cl2(l),在某密闭容器中加入16. 20g氯化硫酰,达到平衡时容器中含SO2 7.616 g。反应后将平衡混合物溶于足量的BaCl2溶液中,则最终生成沉淀的质量
[? ]
A.无法计算
B.等于27.73 g
C.等于0. 233 g
D.等于27. 96 g
参考答案:D
本题解析:
本题难度:一般
3、选择题 如图,隔板K可左右移动,甲中充入2 mol A和1 mol B,乙中充入2 mol C和1 mol He,此时K停在0处。发生反应2A(g)+B(g)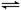 2C(g),达到平衡后,恢复至温度。下列有关说法不正确的是
2C(g),达到平衡后,恢复至温度。下列有关说法不正确的是
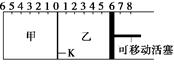
A.达平衡后,隔板K最终停留在左侧刻度0~2之间
B.若平衡时K停留在左侧1处,则活塞停留在右侧6处
C.达到平衡时,甲容器中B的物质的量小于于乙容器中B的物质的量
D.根据隔板K滑动与否可判断左右两边的反应是否达到平衡
参考答案:B
本题解析:反应是体积减小的可逆反应,所以在反应过程中乙中气体的物质的量增加,甲中气体的物质的量减少,因此K向作移动。由于是可逆反应,所以甲中气体的物质的量一定大于2mol,因此隔板K最终停留在左侧刻度0~2之间,A正确。乙容器相当于在甲容器的基础上,平衡时通入稀有气体,在压强不变的情况下,平衡向生成A、B的方向移动,所以选项C正确。当K不再滑动时,说明反应达到平衡状态,D正确。若平衡时K停留在左侧1处,则乙中气体的物质的量变化量大于1个单位,所以B不正确,答案选B。
本题难度:一般
4、选择题 已建立化学平衡的某可逆反应X(g)+2Y(g) 2Z(g),当条件改变使化学平衡向正反应方向移动时,下列叙述正确的是
2Z(g),当条件改变使化学平衡向正反应方向移动时,下列叙述正确的是
①生成物的质量分数一定增加,②生成物总量一定增加,?③反应物的转化率一定增大,
④反应物的浓度一定降低,⑤正反应速率一定大于逆反应速率,⑥一定使用催化剂
A.①②③
B.③④⑤
C.②⑤
D.④⑥
参考答案:C
本题解析:①总质量不变,平衡向正反应移动,生成物的质量分数一定增大,若生成物质量增大小于混合物总质量增大,生成物的质量分数可能降低,故①错误;②平衡向正反应移动,生成物的物质的量一定增加,故②正确;③降低生成物的浓度,平衡向正反应方向移动,反应物的转化率一定增大,但增大某一反应的浓度,平衡向正反应移动,其它反应物的转化率增大,自身转化率降低,故③错误;④如增大反应物的浓度,平衡向正方向移动,达到平衡时,反应物的浓度比改变条件前大,故④错误;⑤平衡向正反应移动,正反应速率一定大于逆反应速率,故⑤正确;⑥加入催化剂,正逆反应速率同等程度增大,平衡不移动,故⑥错误,因此答案选C。
本题难度:一般
5、填空题 已知氯水中有如下平衡:Cl2+H2O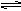 HCl+HclO。
HCl+HclO。
①常温下,在一个体积为50mL的针筒里吸入40mLCl2后,再吸进10mL水,写出针筒中可能观察到的现象是:?。
②若将此针筒长时间放置,又可能看到变化为:?。
试用平衡移动的观点加以解释:?。
参考答案:①针筒向里缩进,气体体积减小,气体、溶液颜色变浅;②气体、溶液颜色接近无色,最终仍有气体大越是原氯气的一半。 2HClO 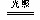 2HCl+O2↑,随着的HClO减少,原平衡不断向右移动,Cl2减少,生成O2,理论上讲:2Cl2→O2。
2HCl+O2↑,随着的HClO减少,原平衡不断向右移动,Cl2减少,生成O2,理论上讲:2Cl2→O2。
本题解析:①由于Cl2会溶解于水,且与水反应:Cl2+H2O=HCl+HClO,故针筒向里缩进,气体体积减小,气体、溶液颜色变浅;②针筒放置时间稍长,由于HClO会分解:2HClO 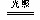 2HCl+O2↑,且理论上讲:2Cl2→O2。故气体、溶液颜色接近无色,最终仍有气体大越是原氯气的一半。
2HCl+O2↑,且理论上讲:2Cl2→O2。故气体、溶液颜色接近无色,最终仍有气体大越是原氯气的一半。
本题难度:一般