1、实验题 石蜡油(17个碳原子以上的液态烷烃混合物)的分解实验装置如图所示(部分仪器已省略)。在试管①中加入石蜡油和氧化铝(催化石蜡分解);试管②放在冷水中,试管③中加入溴水。

实验现象:
试管①中加热一段时间后,可以看到试管内液体沸腾;
试管②中有少量液体凝结,闻到汽油的气味,往液体中滴加几滴高锰酸钾酸性溶液颜色褪去。根据实验现象回答下列问题:
(1) 装置A的作用是______________________________
(2) 试管①中发生的主要反应有:
C17H36 C8H18+C9H18? C8H18
C8H18+C9H18? C8H18 C4H10+C4H8
C4H10+C4H8
丁烷可进一步裂解,除得到甲烷和乙烷外,还可以得到另两种有机物,它们的结构简式为_____________和________________,这两种有机物混合后在一定条件下可聚合成高分子化合物,其反应类型属于________反应。其可能结构为(? )(答案可能不止一个,下同)

(3)写出试管③中反应的一个化学方程式_____________________________,该反应的类型为__________反应。
(4)试管②中的少量液体的组成是____________(填序号)
①甲烷?②乙烯?③液态烷烃?④液态烯烃
参考答案:(1)防止试管③中的液体倒吸到试管②中
(2)CH2=CH2、CH3CH=CH2,加聚,AC
(3)CH2=CH2+Br2→CH2BrCH2Br(CH3CH=CH2+Br2→CH3CHBrCH2Br),加成
(4)③④
本题解析:考查石油的催化裂化及烃的性质
(1)试管A的玻璃管进口与出口均较短,一般起安全瓶的作用,可防止试管③中的液体倒吸到试管②中
(2)烷烃分解一般可得到相同碳原子的烷烃及烯烃,故丁烷分解可得到:
C4H10 CH4+C3H6? C8H18
CH4+C3H6? C8H18 C2H6+C2H4
C2H6+C2H4
所以,丁烷可分解得到甲烷、乙烷、乙烯CH2=CH2、及丙烯CH3CH=CH2
其中乙烯、丙烯可发生加聚反应得到高分子化合物,除自身加聚生成 、
、 外,还可混合加聚,生成
外,还可混合加聚,生成 及
及
(3)乙烯或丙烯可与溴发生加成反应:CH2=CH2+Br2→CH2BrCH2Br、CH3CH=CH2+Br2→CH3CHBrCH2Br
(4)在冷水冷凝作用下,沸点较高的(碳原子大于4)烃被液化为液态,故答案为③④
本题难度:简单
2、简答题 为进行Ⅰ项中的除杂实验(括号内为杂质),请从Ⅱ项中选出一种试剂,从Ⅲ项中选出一合适的实验操作方法分离,将标号填在后面的答案栏内.
| Ⅰ除杂实验 | Ⅱ试剂 | Ⅲ操作方法 | 答案
Ⅰ
Ⅱ
Ⅲ
①苯(苯酚) | A.水
B.NaCl晶体
C.NaOH溶液
D.CaO | a.蒸馏
b.分液
c.盐析
d.过滤
①
______
______
②乙醇(水)
②
______
______
③肥皂(甘油、水)
③
______
______
④硝基苯(硝酸、硫酸)
④
______
______
参考答案:①除去苯中苯酚,可加入NaOH溶液,生成易溶于水的苯酚钠,而苯和水互不相溶,然后分液;
②除去乙醇中的水可用CaO,可吸收水生成难挥发的氢氧化钙,然后蒸馏分离;
③除去肥皂中的甘油和水,可加入NaCl晶体,肥皂在饱和食盐水的溶解度较低,用盐析的方法分离;
④硝基苯不溶于水,可加入水后用分液的方法分离,
故答案为:Ⅰ除杂实验[Ⅱ试剂[Ⅲ操作方法[答案ⅠⅡⅢ①苯(苯酚)A.水
B.NaCl晶体
C.NaOH溶液
D.CaOa.蒸馏
b.分液
c.盐析
d.过滤①Cb②乙醇(水)②Da③肥皂(甘油、水)③Bd④硝基苯(硝酸、硫酸)④Ab
本题解析:
本题难度:一般
3、选择题 下列实验可行的是( )
A.用酒精萃取碘水中的碘
B.加入盐酸以除去硫酸钠溶液中的少量碳酸钠杂质
C.加热氯化铵与氢氧化钙的固体混合物制取氨
D.在容量瓶中加入少量的水,再加入浓硫酸配制一定物质的量浓度的稀硫酸
参考答案:A.酒精与水混溶,不能作萃取剂,则应用苯或四氯化碳萃取碘水中的碘,故A错误;
B.盐酸与碳酸钠反应生成NaCl,会引入新杂质,则应加入硫酸以除去硫酸钠溶液中的少量碳酸钠杂质,故B错误;
C.氯化铵与氢氧化钙反应生成氨气、氯化钙、水,为固体加热制取氨气的原理,实验方案可行,故C正确;
D.不能在容量瓶中稀释浓硫酸,应在烧杯中稀释、冷却后转移到容量瓶中,故D错误;
故选C.
本题解析:
本题难度:简单
4、实验题 (15分)食盐是日常生活的必需品,也是重要的化工原料。
(1)粗食盐常含有少量K+、Ca2+、Mg2+、Fe3+、SO42-等杂质离子,实验室提纯NaCl的流程如下:
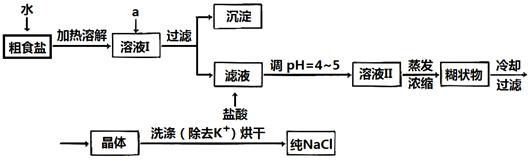
提供的试剂:饱和Na2CO3溶液?饱和K2CO3溶液? NaOH溶液? BaCl2溶液? Ba(NO3)2溶液? 75%乙醇 四氯化碳
①欲除去溶液I中的Ca2+、Mg2+、Fe3+、SO42-离子,选出a所代表的试剂,按滴加顺序依次为_______? __(只填化学式)。
②洗涤除去NaCl晶体表面附带的少量KCl,选用的试剂为_____?____。
(2)用提纯的NaCl配制500 mL4.00 mol·L-1NaCl溶液,所用仪 器除天平、药匙、玻璃棒外还有___?_____(填仪器名称)。 器除天平、药匙、玻璃棒外还有___?_____(填仪器名称)。
(3) 电解饱和食盐水的装置如图所示,

若收集的H2为2 L,?
则同样条件下收集的Cl2______(填“>”、“=”或“<”)2 L,原因是__________。装置改进后,可用于制备NaOH溶液,若测定溶液中NaOH的浓度,常用的方法是_____________。
(4)实验室制备H2和Cl2通常采用下列反应:Zn+H2SO4?ZnSO4+H2↑;MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O,据此,从下列所给仪器装置中选择制备并收集H2的装置_______(填代号)和制备并收集干燥、纯净Cl2的装置_________(填代号)。 MnCl2+Cl2↑+2H2O,据此,从下列所给仪器装置中选择制备并收集H2的装置_______(填代号)和制备并收集干燥、纯净Cl2的装置_________(填代号)。
可选用制备气体的装置:
参考答案:
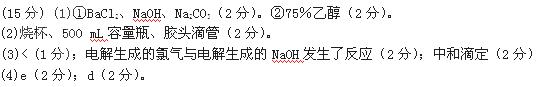
本题解析:略
本题难度:一般
5、实验题 (16分)有一种催化剂为铁的常见的氧化物,为探究该氧化物的成分:
(一)某同学将适量稀硝酸加入少许样品中加热溶解;取少许所得溶液,滴加KSCN溶液,出现红色,由此得出该氧化物中铁元素为+3价,你认为该结论?(合理或不合理),理由:?。
(二)请你完成对该铁的氧化物成分的探究分析:
提出对该氧化物的合理假设:
a.假设1:?;b.假设2:假设该氧化物为FeO;c.假设3:?。
(三)[设计方案证明上述假设,选择合适的仪器和药品]
(四)[实验过程以及结论分析]:(请填写空格①和②)
|