1、选择题 下列叙述中正确的是
A.除零族元素外,所有短周期元素的最高化合价在数值上都等 于该元素所属的族序数
于该元素所属的族序数
B.除短周期外,其他周期均有18种元素
C.副族元素中没有非金属元素
D.碱金属元素是指ⅠA族的所有元素
参考答案:C
本题解析:略
本题难度:一般
2、选择题 下列关于粒子结构的描述不正确的是(? )
A.H2S和NH3均是价电子总数为8的极性分子
B.HS-和HCl均是含有一个极性键的18电子粒子
C.CH2Cl2和CCl4均是四面体构型的非极性分子
D.1 mol 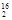 DO中含中子、质子、电子各10NA(NA代表阿伏加德罗常数的值)
DO中含中子、质子、电子各10NA(NA代表阿伏加德罗常数的值)
参考答案:C
本题解析:H2S中H、S元素形成的极性键,但结构不对称,属于极性分子;NH3中含有极性键,空间结构为三角锥形,正负电荷的中心不重合,也属于极性分子,故A正确;HS-和HCl都只含一个极性键,都具有18个电子,故B正确;CH2C12正负电荷的中心不重合,是极性分子,故C错误;1 mol D216O中含中子、质子、电子分别为10 NA,故D正确;故选。
本题难度:一般
3、选择题 下列离子中,与Na+含有相同电子数的是
A.F-
B.Cl-
C.Br-
D.I-
参考答案:A
本题解析:中性原子中质子数=核外电子数,阳离子核外电子数=质子数-电荷守恒,阴离子核外电子数=质子数+电荷数,所以Na+含有的电子数=11-1=10,A中核外电子数=9+1=10,B中核外电子数=17+1=18,C中核外电子数=35+1=36,D中核外电子数=53+1=54,答案选A。
点评:该题是基础性试题的考查,难度不大。明确核外电子数的计算依据是答题的关键,注意分清楚原子、阴离子、阳离子的计算方法的不同。
本题难度:简单
4、选择题 已知aAn+.bB(n+1)+.cCn-.dD(n+1)-均具有相同的电子层结构,关于A、B、C、D四种元素的叙述正确的是?
A. 原子半径:A>B>C>D? B. 原子序数:b>a>c>d
C. 离子半径:D>C>B>A? D. 金属性:B>A,非金属性:D>C
参考答案:B
本题解析:aAn+.bB(n+1)+.cCn-.dD(n+1)-均具有相同的电子层结构,则其核外电子数相同,即a-n=b-n-1=c+n=d+n+1,所以原子序数为b>a>c>d。其中A和B是金属,位于同一周期,A在B的左侧。C和D是非金属,位于A和B的上一周期,其中C在D的右侧。所以原子半径是A>B>D>C,离子半径是b<a<c<d,金属性是A大于B,非金属性是C大于D。因此正确的答案是B。
本题难度:一般
5、填空题 现有A、B、C、D四种元素,A元素形成的—2价阴离子比氦原子的核外电子数多8个,B元素与A元素可组成一种化合物E,为淡黄色固体,该固体遇到空气能生成A的单质;C为原子核内有12个中子的金属元素,当2.4gC与足量热水反应时,在标准状况下放出气体2.24L,C形成正二价阳离子;D元素原子的M层上有7个电子。
(1)写出B、C两种元素的元素名称:B?,C?,指出D在周期表中的位置?。
(2)D的气态氢化物与H2S、HF的稳定性由强到弱为?(用化学式表示)。
(3)写出淡黄色固体E的电子式?,其中含有的化学键为?。
(4)钾元素与B元素位于同一主族,钾元素与A元素可形成K2A、K2A2、KA2等多种化合物,其中K2A2和KA2和CO2均可发生反应(反应与淡黄色固体E和CO2的反应类似),写出KA2与CO2发生反应的化学方程式?。K2A2、KA2在医院、矿井、潜水、高空飞行中常用作供氧剂,为了维持气压稳定可以使用过氧化钾和超氧化钾的混合物使吸收的CO2与生成的O2体积相同(同温同压),则它
们的物质的量之比为?。
参考答案:(1)B:钠;? C:镁;?第三周期第ⅦA族; (2)HF?>? HCl?> H2S?;
(3)Na2O2的电子式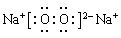 ;?离子键、非极性键(或共价键);
;?离子键、非极性键(或共价键);
(4)4KO2 + 2CO2 =2K2CO3 + 3O2; 1:2
本题解析:A元素形成的—2价阴离子比氦原子的核外电子数多8个,则A是8号元素O;B元素与A元素可组成一种化合物E,为淡黄色固体,该固体遇到空气能生成A的单质,则B为Na元素;C为原子核内有12个中子的金属元素,当2.4gC与足量热水反应时,在标准状况下放出气体2.24L,C形成正二价阳离子;则C为Mg元素;D元素原子的M层上有7个电子。则D为Cl元素。(1)B、C两种元素的元素名称分别是B:钠;C:镁。Cl元素在周期表中的位置是位于第三周期第ⅦA族。(2)Cl、S是同一周期的元素,元素的非金属性Cl>S。元素的非金属性越强,其气态氢化物的稳定性就越强。所以气态氢化物HC>H2S;F、Cl是同一主族的元素。从上到下,元素的原子半径逐渐增大,元素的非金属性逐渐减弱。所以氢化物的稳定性HF >HCl。所以这些元素的氢化物稳定性由强到弱为HF > HCl > H2S。(3)淡黄色固体Na2O2的电子式为: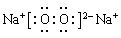 。Na2O2是离子化合物。在Na与O之间以离子键结合,在O、O之间以非极性共价键结合。所以Na2O2中含有的化学键为离子键、非极性键。(4)KO2与CO2发生反应的化学方程式为4KO2 + 2CO2 =2K2CO3 + 3O2;K2O2与CO2反应的方程式为:2K2O2 + 2CO2 =2K2CO3 + O2。若使吸收的CO2与生成的O2体积相同,则n(K2O2):n(KO2)=1:2.
。Na2O2是离子化合物。在Na与O之间以离子键结合,在O、O之间以非极性共价键结合。所以Na2O2中含有的化学键为离子键、非极性键。(4)KO2与CO2发生反应的化学方程式为4KO2 + 2CO2 =2K2CO3 + 3O2;K2O2与CO2反应的方程式为:2K2O2 + 2CO2 =2K2CO3 + O2。若使吸收的CO2与生成的O2体积相同,则n(K2O2):n(KO2)=1:2.
本题难度:一般