1、选择题 室温下,取浓度相同的NaOH和HCl溶液,以3∶2体积比相混合,所得溶液的pH等于12,则该原溶液的浓度为
[? ]
A.0.01?mol·L-1 ?
B.0.017?mol·L-1 ?
C.0.50?mol·L-1 ?
D.0.05?mol·L-1
参考答案:D
本题解析:
本题难度:一般
2、填空题 在t℃时,某NaOH稀溶液中,c(H+)=10-a mol/L,c(OH-)=10-b mol/L,已知a+b=12,则
(1)该温度下水的离子积常数Kw=________。
(2)该NaOH溶液的物质的量浓度的精确值是________mol/L。
(3)在该温度下,将100 mL 0.1 mol/L的稀硫酸与100 mL 0.4 mol/L的NaOH溶液混合后,溶液的pH=_____。
参考答案:(1)10-12 mol2·L-2
(2)10-b-10-a
(3)11
本题解析:
本题难度:一般
3、选择题 25℃,向1LpH?=?a的NaOH溶液中滴加pH?=?b的盐酸10L时,刚好完全中和,则(a+b)的值为?
[?]
A.13?
B.14?
C.15?
D.12
参考答案:C
本题解析:
本题难度:一般
4、选择题 25℃时pH=14的NaOH溶液与pH=1的H2SO4溶液混合,所得混合液的pH=12,则强碱与强酸的体积比为
[? ]
A.1:9?
B.1:11?
C.9:1?
D.11:1
参考答案:A
本题解析:
本题难度:一般
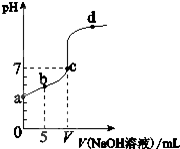
5、选择题 在25℃下,向10.00mL0.01mol/L某一元酸HA溶液中逐滴加入0.01mol/LNaOH溶液,溶液pH变化曲线如右图所示.下列说法正确的是( )
A.HA是弱酸
B.b点表示的溶液中:c(HA)=c(A-)
C.c点时:V=10.00mL
D.b、c、d三点表示的溶液中一定都存在:c(Na+)+c(H+)=c(A-)+c(OH-)