1、填空题 (14分)(1)NO2有较强的氧化性,能将SO2氧化生成SO3,本身被还原为NO,已知下列两反应过程中能量变化如图所示:
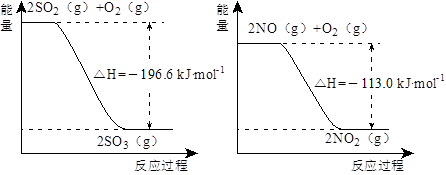
则NO2氧化SO2的热化学方程式为_________________________________。
(2)在2L密闭容器中放入1mol氨气,在一定温度进行如下反应:2NH3(g) N2(g)+3H2(g),
N2(g)+3H2(g),
反应时间(t)与容器内气体总压强(p)的数据见下表
时间t/min
| 0
| 1
| 2
| 3
| 4
| 5
|
总压强p
100 kPa
| 5
| 5.6
| 6.4
| 6.8
| 7
| 7
|
则平衡时氨气的转化率为___________。
(3)25℃,某二元弱酸H2A与NaOH溶液反应可生成NaHA、Na2A,溶液中含A各微粒的分布分数(平衡时某含A微粒的浓度占各含A微粒浓度之和的分数)随溶液变化的情况如下图所示:

已知:103.04=1.1×103,104.37=2.3×104?25℃,Ka1(H2CO3)= 4.4×10-7 ?Ka2(H2CO3) = 4.7×10-11
①若向0.1NaHAmol·L-1溶液中加入少量NaOH溶液,c(A2-)/c(HA-)的值?(填“增大”、“减小”或“不变”,下同),c(H+)/c(OH-) 的值?。
②若向0.1NaHAmol·L-1溶液中加入氨水至溶液呈中性,则c(H2A)+c(NH4+)?c(A2-) (填“大于”、“小于”或“等于”)。
③计算HA-二级电离平衡常数Ka2=?。
④将过量H2A加入Na2CO3溶液中反应的离子方程式为:?。
2、填空题 已知25℃时部分弱电解质的电离平衡常数数据如表所示:
化学式
| CH3COOH
| H2CO3
| HClO
|
电离平衡常数
| Ka=1.8×10-5
| Kal=4.3×10-7
| Ka2=5.6×10-11
| Ka=3.0×10-8
|
| | | |
|
?
回答下列问题:
(1)物质的量浓度均为0.1mol·L-1的四种溶液;a.CH3COONa? b.Na2CO3?c.NaClO? d.NaHCO3
pH由小到大排列的顺序是_______________(用编号填写)。
(2)常温下,0.1mol·L-1CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是?。
A.c(H+ )
B.c(H+)/c(CH3COOH)
C.c(H+)·c(OH-)
D.c(OH-)/c(H+)
E.c(H+)·c(CH3COO-)/c(CH3COOH)
(3)体积均为100mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如下图所示,则同温度时HX的电离平衡常数_?____(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数,理由是_____________________。

(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得pH=6,则溶液中c(CH3COO-)-c(Na+)=?mol·L-1(填精确值)。
(5)标准状况下,将1.12L CO2通入100mL 0.75mol·L-1的NaOH溶液中,则溶液中离子的浓度由大到小的顺序?
3、选择题 已知相同条件下同浓度的NaCN与NaF的稀溶液,前者的pH值大于后者,相同条件下比较同浓度同体积两种溶液中的关系,其中正确的是
[? ]
A.c(CN-)>c(F-)
B.c(CN-)=c(F-) ?
C.NaCN水解程度比NaF大
D.NaCN电离程度比NaF大
4、选择题 人体血液的正常pH约为7.35~7.45,若在外界因素作用下突然发生改变就会引起“酸中毒”或“碱中毒”,甚至有生命危险。由于人体体液的缓冲系统中存在如下平衡:
H++HCO3- H2CO3
H2CO3 CO2+H2O
CO2+H2O
H++PO43- HPO42-?
HPO42-?
H++HPO42- H2PO4-
H2PO4-
故能维持血液pH的相对稳定,以保证正常生理活动。下列说法中不合理的是
A.当强酸性物质进入人体的体液后,上述缓冲系统的平衡向右移,从而维持pH稳定
B.当强碱性物质进入人体的体液后,上述缓冲系统的平衡向左移,从而维持pH稳定
C.某病人在静脉滴注的大量生理盐水后,血液被稀释,会导致c(H+)显著减少,pH值显著增大,可能会引起碱中毒
D.在人体进行呼吸活动时,如CO2进入血液,会使平衡向左移动,c(H+)增大,pH值略减小
5、选择题 室温下,向amo1·L-1氨水中逐滴加入盐酸,下列描述不正确的是
A.溶液的pH减小
B. 增大
增大
C.水的电离程度先减小后增大
D. 不变
不变