1、填空题 (14分)(1)NO2有较强的氧化性,能将SO2氧化生成SO3,本身被还原为NO,已知下列两反应过程中能量变化如图所示:
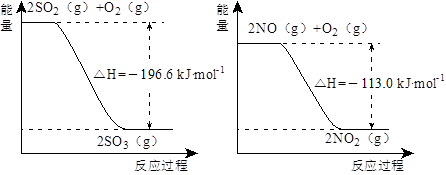
则NO2氧化SO2的热化学方程式为_________________________________。
(2)在2L密闭容器中放入1mol氨气,在一定温度进行如下反应:2NH3(g) N2(g)+3H2(g),
N2(g)+3H2(g),
反应时间(t)与容器内气体总压强(p)的数据见下表
时间t/min
| 0
| 1
| 2
| 3
| 4
| 5
|
总压强p
100 kPa
| 5
| 5.6
| 6.4
| 6.8
| 7
| 7
|
则平衡时氨气的转化率为___________。
(3)25℃,某二元弱酸H2A与NaOH溶液反应可生成NaHA、Na2A,溶液中含A各微粒的分布分数(平衡时某含A微粒的浓度占各含A微粒浓度之和的分数)随溶液变化的情况如下图所示:

已知:103.04=1.1×103,104.37=2.3×104?25℃,Ka1(H2CO3)= 4.4×10-7 ?Ka2(H2CO3) = 4.7×10-11
①若向0.1NaHAmol·L-1溶液中加入少量NaOH溶液,c(A2-)/c(HA-)的值?(填“增大”、“减小”或“不变”,下同),c(H+)/c(OH-) 的值?。
②若向0.1NaHAmol·L-1溶液中加入氨水至溶液呈中性,则c(H2A)+c(NH4+)?c(A2-) (填“大于”、“小于”或“等于”)。
③计算HA-二级电离平衡常数Ka2=?。
④将过量H2A加入Na2CO3溶液中反应的离子方程式为:?。
参考答案:(1) NO2(g)+SO2(g) SO3(g)+NO(g)? ΔH=-41.8KJ/mol; (2)40%;
SO3(g)+NO(g)? ΔH=-41.8KJ/mol; (2)40%;
(3)①增大,减小;② =;③4.35×10-5;④2H2A+CO32-=2HA-+CO2↑+H2O
本题解析:(1)根据图一可知热化学方程式为①2SO2(g) +O2(g)  2SO3(g)ΔH="-196.6KJ/mol;" ②2NO(g)+ O2(g)
2SO3(g)ΔH="-196.6KJ/mol;" ②2NO(g)+ O2(g)  2NO2(g) ΔH="-113.0KJ/mol;" ①-②整理可得NO2(g)+SO2(g)
2NO2(g) ΔH="-113.0KJ/mol;" ①-②整理可得NO2(g)+SO2(g)  SO3(g)+NO(g)? ΔH =-41.8KJ/mol;(2)由于反应是在体积固定的容器中进行,所以反应前后的压强比等于气体的物质的量的比。2NH3(g)
SO3(g)+NO(g)? ΔH =-41.8KJ/mol;(2)由于反应是在体积固定的容器中进行,所以反应前后的压强比等于气体的物质的量的比。2NH3(g) N2(g)+3H2(g)假设有2xmol的氨气反应,则产生N2=xmol;产生H2=3xmol。还有未反应的氨气的物质的量为(1-2x)mol.n(前):n(后)=1:((1-2x)+x+3x)=1:(1+2x)=5:7.解得x=0.2.所以氨气的转化率为(2×0.2)÷1×100%=40%;(3)?①若向0.1NaHAmol·L-1溶液中加入少量NaOH溶液,发生反应:HA-+OH-=H2O+A2-,所以c(A2-)/c(HA-)的值增大;当不断加入NaOH溶液时,c(H+)减小,c(OH-) 增大,所以c(H+)/c(OH-) 的值减小。②根据物料守恒可得c(Na+)= c(HA-)+ c(H2A)+ c(A2-);根据电荷守恒可得:c(Na+)+ c(H+)+ c(NH4+)= c(OH-)+ 2c(A2-)+ c(HA-)。又因为溶液显中性,所以c(H+)= c(OH-)。将三个式子整理可得c(H2A)+c(NH4+)=c(A2-)。③HA-
N2(g)+3H2(g)假设有2xmol的氨气反应,则产生N2=xmol;产生H2=3xmol。还有未反应的氨气的物质的量为(1-2x)mol.n(前):n(后)=1:((1-2x)+x+3x)=1:(1+2x)=5:7.解得x=0.2.所以氨气的转化率为(2×0.2)÷1×100%=40%;(3)?①若向0.1NaHAmol·L-1溶液中加入少量NaOH溶液,发生反应:HA-+OH-=H2O+A2-,所以c(A2-)/c(HA-)的值增大;当不断加入NaOH溶液时,c(H+)减小,c(OH-) 增大,所以c(H+)/c(OH-) 的值减小。②根据物料守恒可得c(Na+)= c(HA-)+ c(H2A)+ c(A2-);根据电荷守恒可得:c(Na+)+ c(H+)+ c(NH4+)= c(OH-)+ 2c(A2-)+ c(HA-)。又因为溶液显中性,所以c(H+)= c(OH-)。将三个式子整理可得c(H2A)+c(NH4+)=c(A2-)。③HA- H++A2-。由图像可知。当达到电离平衡时c(HA-)=c(A2-).
H++A2-。由图像可知。当达到电离平衡时c(HA-)=c(A2-).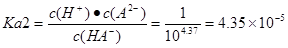 。④由于H2A过量,结合两种酸的电离平衡常数可知过量的H2A加入到Na2CO3溶液中反应的离子方程式为:2H2A+CO32-=2HA-+CO2↑+H2O。
。④由于H2A过量,结合两种酸的电离平衡常数可知过量的H2A加入到Na2CO3溶液中反应的离子方程式为:2H2A+CO32-=2HA-+CO2↑+H2O。
本题难度:一般
2、填空题 已知25℃时部分弱电解质的电离平衡常数数据如表所示:
化学式
| CH3COOH
| H2CO3
| HClO
|
电离平衡常数
| Ka=1.8×10-5
| Kal=4.3×10-7
| Ka2=5.6×10-11
| Ka=3.0×10-8
|
| | | |
|
?
回答下列问题:
(1)物质的量浓度均为0.1mol·L-1的四种溶液;a.CH3COONa? b.Na2CO3?c.NaClO? d.NaHCO3
pH由小到大排列的顺序是_______________(用编号填写)。
(2)常温下,0.1mol·L-1CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是?。
A.c(H+ )
B.c(H+)/c(CH3COOH)
C.c(H+)·c(OH-)
D.c(OH-)/c(H+)
E.c(H+)·c(CH3COO-)/c(CH3COOH)
(3)体积均为100mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如下图所示,则同温度时HX的电离平衡常数_?____(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数,理由是_____________________。

(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得pH=6,则溶液中c(CH3COO-)-c(Na+)=?mol·L-1(填精确值)。
(5)标准状况下,将1.12L CO2通入100mL 0.75mol·L-1的NaOH溶液中,则溶液中离子的浓度由大到小的顺序?
参考答案:(1)a<d<c<b (1分)
(2)BD(2分)
(3)大于(1分) 稀释相同倍数,一元酸HX的pH变化比CH3COOH的大,故HX酸性较强,电离平衡常数较大 (2分)
(4)9.9×10-7?(2分)
(5) c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)(2分)
本题解析:(1)四种溶液中,只有CH3COOH是酸,显示酸性,水解程度:CO32﹣>ClO﹣>HCO3﹣,水解均显碱性,水解程度越大,碱性越强,所以碱性顺序是:Na2CO3>NaClO>NaHCO3,即pH由小到大的排列顺序是CH3COOH<NaHCO3<NaClO<Na2CO3,故答案为:adcb;(2)A、0.1mol?L﹣1的CH3COOH溶液加稀释过程中,电离程度增大,各个微粒浓度减小,故A错误;B、0.1mol?L﹣1的CH3COOH溶液加稀释过程中,各个微粒浓度减小,同时醋酸的电离向右移动,c(H+)减小的程度小于c(CH3COOH)的减小程度,所以c(H+)/c(CH3COOH)增大,故B正确;C、Kw=c(H+)?c(OH﹣)只受温度的影响,温度不变则其值是一个常数,故C错误;D、醋酸稀释,酸性减弱,c(H+)减小,碱性增强,c(OH﹣)增大,即c(OH﹣)/c(H+)增大,故D正确,故选BD。(3)根据CH3COOH与一元酸HX加水稀释过程中pH与溶液体积的关系图可以看出HX酸在稀释过程中溶液的PH变化比醋酸的大,所以酸性HX强于醋酸,电离程度:HX>CH3COOH,故答案为:大于;稀释相同倍数,一元酸HX的pH变化比醋酸大,故酸性强,电离平衡常数大;(4)CH3COOH与CH3COONa的混合溶液中,存在电荷守恒:c(Na+)+c(H+)=c(OH﹣)+c(CH3COO﹣),所以c(CH3COO﹣)﹣c(Na+)=c(H+)﹣c(OH﹣)=10﹣6mol/L﹣10﹣8mol/L=9.9×10﹣7mol/L。(5)标准状况下,将1.12L CO2是0.05mol,和 0.075mol的NaOH反应后生成碳酸钠和碳酸氢钠的混合溶液,两都都为0.025mol,溶液呈碱性,由于碳酸根的水解生成碳酸氢根的程度较大,则溶液中离子的浓度由大到小的顺序c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)。
本题难度:困难
3、选择题 已知相同条件下同浓度的NaCN与NaF的稀溶液,前者的pH值大于后者,相同条件下比较同浓度同体积两种溶液中的关系,其中正确的是
[? ]
A.c(CN-)>c(F-)
B.c(CN-)=c(F-) ?
C.NaCN水解程度比NaF大
D.NaCN电离程度比NaF大
参考答案:C
本题解析:
本题难度:一般
4、选择题 人体血液的正常pH约为7.35~7.45,若在外界因素作用下突然发生改变就会引起“酸中毒”或“碱中毒”,甚至有生命危险。由于人体体液的缓冲系统中存在如下平衡:
H++HCO3- H2CO3
H2CO3 CO2+H2O
CO2+H2O
H++PO43- HPO42-?
HPO42-?
H++HPO42- H2PO4-
H2PO4-
故能维持血液pH的相对稳定,以保证正常生理活动。下列说法中不合理的是
A.当强酸性物质进入人体的体液后,上述缓冲系统的平衡向右移,从而维持pH稳定
B.当强碱性物质进入人体的体液后,上述缓冲系统的平衡向左移,从而维持pH稳定
C.某病人在静脉滴注的大量生理盐水后,血液被稀释,会导致c(H+)显著减少,pH值显著增大,可能会引起碱中毒
D.在人体进行呼吸活动时,如CO2进入血液,会使平衡向左移动,c(H+)增大,pH值略减小
参考答案:C
本题解析:人体体液的缓冲系统中存在如下平衡:H++HCO3- H2CO3
H2CO3 CO2+H2O、H++PO43-
CO2+H2O、H++PO43- HPO42- 、H++HPO42-
HPO42- 、H++HPO42- H2PO4-,所以当强酸性物质进入人体的体液后,上述缓冲系统的平衡向右移,从而维持pH稳定,故A正确;当强碱性物质进入人体的体液后,上述缓冲系统的平衡向左移,从而维持pH稳定,故B正确;某病人在静脉滴注的大量生理盐水后,血液被稀释,会导致c(H+)显著减少,但是pH值不会减小,故C错误,为本题的答案;在人体进行呼吸活动时,如CO2进入血液,会使平衡向左移动,c(H+)增大,pH值略减小,故D正确。
H2PO4-,所以当强酸性物质进入人体的体液后,上述缓冲系统的平衡向右移,从而维持pH稳定,故A正确;当强碱性物质进入人体的体液后,上述缓冲系统的平衡向左移,从而维持pH稳定,故B正确;某病人在静脉滴注的大量生理盐水后,血液被稀释,会导致c(H+)显著减少,但是pH值不会减小,故C错误,为本题的答案;在人体进行呼吸活动时,如CO2进入血液,会使平衡向左移动,c(H+)增大,pH值略减小,故D正确。
点评:本题考查了电离平衡,该知识点是高考考查的重点,本题难度不大。
本题难度:一般
5、选择题 室温下,向amo1·L-1氨水中逐滴加入盐酸,下列描述不正确的是
A.溶液的pH减小
B. 增大
增大
C.水的电离程度先减小后增大
D. 不变
不变
参考答案:C
本题解析:A、氨水中存在电离平衡NH3·H2O NH4++OH-,加入盐酸,溶液的酸性增强,pH降低,A正确;B、盐酸中和氢离子,促进电离平衡向正反应方向移动,溶液中c(NH4+)增大,c(OH-),所以
NH4++OH-,加入盐酸,溶液的酸性增强,pH降低,A正确;B、盐酸中和氢离子,促进电离平衡向正反应方向移动,溶液中c(NH4+)增大,c(OH-),所以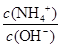 增大,B正确;C、酸或碱都是抑制水的电离平衡,所以溶液中水的电离程度始终是减小的,C不正确;D、电离常数只与温度有关系,所以氨水的电离常数是不变的,D正确,答案选C。
增大,B正确;C、酸或碱都是抑制水的电离平衡,所以溶液中水的电离程度始终是减小的,C不正确;D、电离常数只与温度有关系,所以氨水的电离常数是不变的,D正确,答案选C。
本题难度:一般