1、简答题 将12.8g铜与一定浓度、一定体积的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为4.48L,将反应后的溶液稀释至500mL,请计算:
(1)反应后溶液中硝酸铜的物质的量浓度?
(2)NO,NO2在标准状况下体积各为多少升?
参考答案:(1)12.8g铜的物质的量为12.8g64g/mol=0.2mol,反应生成Cu(NO3)2,根据铜原子守恒可知n[Cu(NO3)2]=n(Cu)=0.2mol,故反应后,溶液中硝酸铜物质的量浓度为0.2mol0.5L=4.4mol/L,
答:反应后溶液中硝酸铜物质的量浓度为0.4mol/L;
(2)4.48L混合气体的物质的量为4.48L22.4L/mol=0.2mol,令混合气体中NO和NO2物质的量分别为xmol、ymol,
由电子转移守恒有:3x+y=0.2×2,
由二者物质的量之和:x+y=0.2
联立方程,解得x=0.1,y=0.1,
故NO的体积为0.1mol×22.4L/mol=2.24L,NO2的体积为0.1mol×22.4L/mol=2.24L,
答:NO、NO2的体积分别为2.24L、2.24L.
本题解析:
本题难度:一般
2、选择题 将18.2gMg、Al、Fe组成的合金溶于足量的NaOH溶液中,可产生0.3mol气体.另取等质量合金溶于过量稀硝酸中,生成NO气体,向反应后的溶液中加入NaOH溶液恰好使Mg2+、Al3+、Fe3+完全转化为沉淀,其质量为43.7g,则上述反应中生成NO气体的体积(标况下)为( )
A.22.4L
B.11.2L
C.33.6L
D.6.72L
参考答案:氢氧化镁、氢氧化铝、氢氧化铁的总质量为43.7g,沉淀中氢氧根的质量为43.7g-18.2g=25.5g,物质的量为25.5g17g/mol=1.5mol,根据电荷守恒可知,金属提供的电子的物质的量等于氢氧根的物质的量,令NO的物质的量为xmol,根据电子转移守恒有(5-2)×xmol=1.5mol,解得x=0.5,所以生成的NO的体积为0.5mol×22.4L/mol=11.2L.
故选:B.
本题解析:
本题难度:一般
3、填空题 4分)按要求写出相应的化学用语:
①甲基(电子式)?;②氢氧根(电子式)?;
参考答案: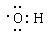 ?、
?、
本题解析:考查化学用语的书写。甲基是电中性的,而氢氧根带1个负电荷,所以二者的电子式分别为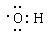 、
、 。
。
本题难度:一般
4、选择题 下列化学反应中,属于置换反应的是(?)?
A.NaOH + HCl ="=" NaCl + H2O
B.H2+ CuO  Cu + H2O
Cu + H2O
C.Fe2O3 +3CO 2 Fe + 3CO2
2 Fe + 3CO2
D.2CO + O2 2CO2
2CO2
参考答案:B
本题解析:略
本题难度:简单
5、选择题 下列单位中,不属于国际单位制中七种基本计量单位之一的是( )
A.米
B.千克
C.摩尔
D.厘米
参考答案:D
本题解析:厘米不是基本单位。
本题难度:简单