1、选择题 下列反应的离子方程式书写正确的是
A.氯气被冷的氢氧化钠溶液吸收:Cl2+ 2OHˉ=Clˉ+ ClO2ˉ+ H2↑
B.将二氧化碳通入稀碳酸钠溶液:CO2 + CO32ˉ+ H2O=2HCO3ˉ
C.硫酸铜溶液与氢氧化钡溶液反应:Ba2+ + SO42ˉ=Ba SO4↓
D.二氧化氮气体溶于水:2NO2+H2O=2H++NO3ˉ+NO
参考答案:B
本题解析:氯气与氢氧化钠溶液反应没有氢气产生,A错误;二氧化碳与碳酸钠反应生成碳酸氢钠,所以B正确;硫酸铜遇氢氧化钡反应的离子反应方程式为 ,所以C错误;二氧化氮与水反应生成硝酸和一氧化氮,但离子反应方程式电荷不守恒D错误;所以答案选B。
,所以C错误;二氧化氮与水反应生成硝酸和一氧化氮,但离子反应方程式电荷不守恒D错误;所以答案选B。
本题难度:一般
2、简答题 将0.65g锌加到50mL1mol?L的盐酸中,
(1)写出发生反应的离子方程式______.
(2)计算生成H2的体积______.(标准状况下)
(3)若反应结束后,溶液的体积仍为50mL,求此时溶液中的Zn2+和H+的物质的量浓度.
参考答案:(1)锌和盐酸反应生成氯化锌和氢气,反应的离子方程式为:Zn+2H+=Zn2++H2↑,故答案为:Zn+2H+=Zn2++H2↑;
(2)将0.65g锌物质的量=0.65g65g/mol=0.01mol,50mL1mol?L的盐酸中溶质物质的量=0.050L×1mol?L-1=0.05mol;
Zn+2HCl=ZnCl2+H2↑
0.01mol 0.02mol
可知氯化氢过量,依据反应的锌物质的量计算生成氢气物质的量为0.01mol,标准状况下气体体积=0.01mol×22.4L/mol=0.224L,
故答案为:0.224L;
(3)由化学方程式可知生成的锌离子物质的量为0.01mol,剩余氢离子物质的量=0.05mol-0.02mol=0.03mol,若反应结束后,溶液的体积仍为50mL依据c=nV计算浓度,锌离子浓度=0.01mol0.05L=0.2mol/L,氢离子浓度=0.03mol0.05L=0.6mol/L,
答:溶液中的Zn2+的物质的量浓度为0.2mol/L,H+物质的量浓度为0.6mol/L.
本题解析:
本题难度:一般
3、选择题 下列离子方程式正确的是
A.向小苏打溶液中加入甲酸溶液:HCO3-+H+
B.甲酸苯酯与银氨溶液水浴加热的化学方程式:

C.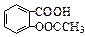 在足量烧碱液中水解:
在足量烧碱液中水解:
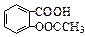 +2OH-eq o(sup 9(—→
+2OH-eq o(sup 9(—→ +CH3COO-+2H2O
+CH3COO-+2H2O
D.向C6H5ONa溶液中通入少量CO2:2C6H5O-+CO2+H2O 2C6H5OH+CO2-3
2C6H5OH+CO2-3
参考答案:B
本题解析:略
本题难度:一般
4、选择题 下列离子方程式正确的是(?)
A.向盐酸中滴加氨水:H++OH-=H2O
B.Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+=Fe3++3H2O
C.铜溶于稀硝酸:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
D.Na2S2O3溶液中通入足量氯气:S2O32-+2Cl2+3H2O=2SO32-+4Cl-+6H+
参考答案:C
本题解析:A.氨水中的一水合氨是弱碱,不能写成离子形式,错误;B.Fe(OH)3溶于氢碘酸产生的Fe3+会与I-发生氧化还原反应,因此离子方程式是:2Fe(OH)3+6H+=2Fe2++6H2O+3I2。错误。C.铜溶于稀硝酸:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O反应原理符合事实,拆写无误,正确;D.Na2S2O3溶液中通入足量氯气,会发生氧化还原反应:S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+,错误.
本题难度:一般
5、填空题 亚硝酸钠(NaNO2)是一种工业用盐,有像食盐一样的咸味,常被误食引起中毒。已知氢碘酸(HI)与NaNO2反应生成碘单质和一氧化氮气体。
(1)上述反应的离子方程式为?。
(2)上述反应中,氧化剂是?,发生氧化反应的物质是?。
(3)根据上述反应,可以用试纸和生活中常见的物质进行实验,来鉴别亚硝酸钠和食盐。可选用的物质有:①自来水②碘化钾淀粉试纸③淀粉④白糖⑤食醋⑥白酒。进行实验时,必须选用的物质有(填写序号)?。
参考答案:(1)离子方程式为? 2NO2—+2I― + 4H+ → I2 + 2NO↑ + 2H2O?。
(2)? NaNO2?,? HI 。(3)?②⑤
本题解析:略
本题难度:简单